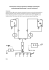ROZDZIELANIE I IDENTYFIKACJA JONÓW NA DRODZE
Transkrypt
ROZDZIELANIE I IDENTYFIKACJA JONÓW NA DRODZE
ROZDZIELANIE I IDENTYFIKACJA JONÓW NA DRODZE IZOTACHOFOREZY Instrukcja do ćwiczeń opracowana w Katedrze Chemii Środowiska Uniwersytetu Łódzkiego. Podstawę rozdzielania na drodze elektroforezy stanowi ruch naładowanych cząstek w polu elektrycznym. Natężenie pola E równoznaczne z gradientem napięcia, mierzy się różnicą potencjałów w dwóch punktach pola podzieloną przez odstęp miedzy nimi. Na cząsteczkę o ładunku Z w polu E działa siła ZE, która w przypadku cząsteczki znajdującej się w próżni spowoduje, że będzie się ona poruszała ruchem przyspieszonym spełniając równanie: d 2x dt 2 m ZE gdzie: m - masa cząsteczki, x - droga. Naładowane cząsteczki w roztworach czyli jony, nie mają możliwości poruszania się ruchem przyspieszonym ze względu na działanie siły oporu proporcjonalnej do szybkości. Po upływie bardzo krótkiego czasu obie działające na jon siły się równoważą, ZE f dx dt gdzie: f - współczynnik oporu. Dzieląc szybkość jonu przez gradient napięcia otrzymamy wielkość zwaną ruchliwością, ang. mobility, u u 1 dx E dt Z f Rozróżniamy ruchliwość efektywną odpowiadającą aktualnej średniej wartości dla danego roztworu i efektywność absolutną odpowiadającą wartości dla nieskończonego rozcieńczenia. Wymiar ruchliwości cm2s-1V-1. W ciągu jednej sekundy jeden g-mol jonu przeniesie na odstęp 1 cm przy polu E = 1 ładunek równy ZuF kulombów, gdzie - F stała Faradaya wynosząca 96500 kulombów. Oznaczając przez C liczbę moli danego jonu w 1 cm 3 roztworu suma ładunków przeniesiona przez wszystkie jony wyniesie, F ui Ci Zi 1 oznacza przepływ ładunku przy E = 1 przez 1 cm2 na drodze 1 cm, a więc gdzie przewodność właściwą roztworu w układzie CGS. W układzie SI jednostką przewodności jest siemens, a przewodności właściwej siemens na metr. Mnożąc przewodność właściwą przez gradient napięcia otrzymamy gęstość prądu w amperach na cm2 lub na m2. W czasie przepływu prądu wynoszącym 1 sekundę wydziela się w 1 cm3 ilość ciepła w dżulach równa iloczynowi gradientu napięcia przez gęstość prądu. Ruchliwość jonów rośnie z temperaturą ponieważ obniża się lepkość roztworu i maleje stopień solwatacji. Ruchliwość jonów jest związana ze współczynnikiem dyfuzji równaniem, u ZD RT Zgodnie z tym równaniem ruchliwość powinna maleć w miarę zmniejszania się współczynnika dyfuzji, o którym wiadomo, że maleje ze wzrostem masy cząsteczkowej. Porównanie jednak ruchliwości jonów nieorganicznych pozornie przeczy tej zależności, gdyż np. w szeregu lit, sód, potas ruchliwość rośnie w miarę wzrostu masy atomowej. Zjawisko to można wyjaśnić różnicą w stopniu solwatacji - różnicą w liczbie cząsteczek wody związanej przez jon. Powoduje to, że masa uwodnionego jonu litowego jest większa niż masy uwodnionego jonu sodowego. Dopiero porównanie jonów o takiej samej grupie jonogennej, np. kwasów karboksylowych, pozwala prawidłowo ustalić zależność między masą i ruchliwością przy całkowitej jonizacji. Niewspółmiernie wysoką ruchliwość jonu wodorowego H3O+ i OH- wodorotlenowego tłumaczymy występowaniem obok przewodnictwa jonowego z przeniesieniem masy również przewodnictwa elektronowego bez przenoszenia masy. Efektywny ładunek jonów utworzonych z kwasu X wyraża wzór Cix Zix Z ef Cix , zaś efektywną ruchliwość uef uix Cix Cix Dla jednozasadowego kwasu Zef jest równy stopniowi jonizacji , a uef iloczynowi Zef przez ruchliwość absolutną. Dla kwasu HA: A A HA , K H A HA K , H 2 K , uef uo Dla reakcji odszczepienia protonu od uprotonowanej zasady B wartości K B H BH , BH B i K wyniosą, H BH K H Z powyższych wzorów można wyprowadzić zależność, pKa pH log 1 gdzie znak plus odnosi się do kwasów, minus do zasad. Jezeli = 0.5 to pKa = pH. Jednocześnie u = 0.5 uo. Rys. 1. przedstawia teoretyczna zależność stopnia jonizacji (dysocjacji) od pH dla trzech jednozasadowych kwasów o wartościach pKa 3, 6 i 9. Rys. 2. ilustruje zależność efektywnej ruchliwości od pH. Krzywe a, b i c odnoszą się do substancji, które w środowisku kwaśnym przyłączają proton, krzywa d - do substancji oddajacej w środowisku alkalicznym proton. Krzywa e odnosi się do substancji amfiprotycznej, która w środowisku kwaśnym jest kationem, w alkalicznym anionem. Tu należą aminokwasy i białka. Rys. 1. Stopień dysocjacji kwasów o pKa 3, 6 i 9 jako funkcja pH. 3 Rys. 2. Szybkość elektromigracji substancji zasadowych a, b, c, kwasowej d i amfoterycznej e, jako funkcja pH. KLASYFIKACJA METOD ROZDZIELANIA Metody rozdzielania i analizy jonów na drodze elektroforezy można klasyfikować według różnych kryteriów. Elektroforeza może być prowadzona bezpośrednio w roztworach, na bibule, w żelach, na różnych nośnikach w postaci proszku, na płytkach, w kolumnie lub w kapilarze. Jako nośnik może być użyte pojedyncze włókienko bawełny. Największe znaczenie posiada elektroforeza w żelach i w kapilarach. Rys. 3 przedstawia podstawowe metody prowadzenia rozdzielania na drodze elektroforezy. Każda metoda może być realizowana w żelach lub innych nośnikach i w kapilarach. Schemat a przedstawia elektroforezę pasmową. Jest to najstarszy i najbardziej rozpowszechniony sposób prowadzenia elektroforezy. Anolit i katolit stanowią ten sam bufor. Wprowadzona próbka rozdziela się na kationy i aniony, które wędrują w przeciwstawnych kierunkach i rozdzielają się w wyniku różnicy szybkości migracji. Schemat b przedstawia metodę ruchomej granicy (moving boundary). Próbkę umieszcza się między buforami o tym samym składzie i poddaje elektroforezie. Z jednej strony oddziela się składnik najszybszy (A), z drugiej pozostaje składnik najwolniejszy. W następnej warstwie obok składnika A zjawia się powolniejszy składnik B, a w następnej warstwie jeszcze 4 powolniejszy składnik X. Istotą różnicy w metodzie a i b jest wielkość próbki. W pierwszym przypadku próbka jest niewielka, co umożliwia całkowite rozdzielenie, w drugim duża, co prowadzi tylko do częściowego rozdzielenia. Rys. 3. Podstawowe metody rozdzielania na drodze elektroforezy; a – elektroforeza pasmowa, elektrolit A- B+; b – elektroforeza ruchomej granicy, elektrolit A- B+, powstają strefy: aniony A-, A- + B-, A- + B- + C-; c – izotachoforeza, elektrolit wiodący L- E+, elektrolit zakończający T- E+, dla roztworu anionów. Powstają pasma: B- E+, C- E+ przesuwające się ze stałą szybkością przy stałym natężeniu prądu; d – izoelektroogniskowanie. Przez wprowadzenie amfolitów tworzy się liniowy gradient pH. Substancje skupiają się w pasmach odpowiadających ich punktom izoelektrycznym. 5 Trzeci schemat obrazuje rozdzielanie na drodze izotachoforezy. W przypadku rozdzielania anionów, aniony w próbce mają ruchliwość niższą od ruchliwości anionu wiodącego A i wyższą od ruchliwości anionu zakończającego T w katolicie. Jony próbki umieszczone między anolitem A i katolitem T ulegają rozdzielaniu zgodnie z efektywnymi ruchliwościami, tworząc przylegające do siebie strefy, które migrują ze stałą szybkością przy stałym natężeniu prądu. Elektroforeza izoelektrycznie skupiająca (isoelectric focusing), polega na wytworzeniu gradientu pH. Metoda przeznaczona jest dla substancji amfiprotycznych, przyjmującym ładunek dodatni w kwaśnym i ujemny w alkalicznym środowisku. Migracja do anody lub katody będzie przebiegała tak długo, aż cząsteczka dojdzie do pH, w którym zaniknie jej ładunek, tzn. do punktu izoelektrycznego. A więc w tej metodzie rozdział następuje nie według szybkości, lecz według punktów izoelektrycznych. IZOTACHOFOREZA Sposób przeprowadzenia kapilarnej izotachoforezy ilustruje Rys. 4. Próbka zostaje umieszczona między dwoma elektrolitami, z których jeden zwany jest elektrolitem wiodącym, drugi - zakończającym. W przypadku analizy anionów elektrolit wiodący zawiera aniony A, zakończający T, tak dobrane, aby ich efektywne ruchliwości obejmowały efektywne ruchliwości anionów w próbce, tzn. aby spełniona była nierówność: uT < u1 < u2 < u3 < uA, gdzie u1, u2, u3 - efektywne ruchliwości anionów w próbce. Po określonym czasie przy wystarczającej długości kapilary przepływający prąd spowoduje uszeregowanie anionów zgodnie z ich ruchliwościami. Powstaną strefy zawierające jednolite aniony. Strefy te nie mogą się rozłączyć jak w przypadku elektroforezy pasmowej, gdyż musiałaby powstać strefa nie zawierająca żadnych anionów, co jest niemożliwe. W elektroforezie pasmowej między rozdzielone strefy wchodzą aniony buforu. W izotachoforezie strefy przylegają do siebie i wędrują ze stałą szybkością, stąd nazwa metody. 6 Rys. 4. Schemat zestawu do kapilarnej jednokolumnowej izotachoforezy. A – zestaw normalny, B – zestaw umożliwiający zbieranie frakcji, gdzie: L i T – bufory wiodący i zakończający, D – detektor, m – membrana. To samo odnosi się oczywiście również do kationów, które będą się ustawiać w strefach między najszybszym kationem elektrolitu wiodącego i najpowolniejszym kationem elektrolitu zakończającego. Dla migrujących ze stałą szybkością uporządkowanych stref jednolitych anionów możemy napisać: gdzie v - szybkość w cm/s. vT = v1 = v2 = v3 = vL, Ponieważ v = uE, gdzie E - gradient napięcia uTET = u1E1 = u2E2 = u3E3 = uLEL. Wynika z tego, że w każdej strefie panuje inny gradient napięcia spełniający nierówność ET > E1> E2> E3> EA Ponieważ natężenie prądu jest stałe, a iloczyn Ei, gradientu napięcia przez natężenie prądu, oznacza ilość ciepła wydzielonego w strefie na 1 cm i 1 sekundę, więc strefy będą miały różne temperatury: TT > T1 > T2 > T3 > TL Przewodność właściwa elektrolitu zawierającego jeden rodzaj anionów i jeden rodzaj kationów wynosi: = Ca ua Za F + Ck uk Zk F 7 gdzie C, u, Z, F oznaczają kolejno stężenie, ruchliwość i ładunek anionu i kationu, oraz stałą Faradaya. Uwzględniając, że Ca Za = Ck Zk suma ładunków anionów równa się sumie ładunków kationów, otrzymamy: = Ca Za F (ua + uk) Stała gęstość prądu, amper/cm2, jest równa iloczynowi przewodności właściwej przez gradient napięcia: i= 1E1 = 2E2 = const. Rozpatrzmy teraz dwa elektrolity zawierające aniony A i B oraz wspólny kation K. W procesie izotachoforezy aniony A i B utworzą osobne pasma o przewodnościach właściwych: C A Z A F (u A A Uwzględniając, że EA A = EB B uK ) , B C B Z B F (u B uK ) otrzymamy, E A C A Z A F (u A uK ) E B CB Z B F (u B uK ) Stężenie anionu B w strefie B wyniesie CB CA E A Z A (u A E B Z B (u B uK ) uK ) Ponieważ jednak w procesie izotachoforezy spełniona jest równość E Au A EB u B , E A / EB uB / u A , CB CA ostatecznie otrzymamy u B Z A (u A u A Z B (u B uK ) uK ) CA J Współczynnik J posiada dla danego układu jonów stałą wartość. A więc stężenie anionu w jednej strefie będzie proporcjonalne do stężenia drugiego anionu w drugiej strefie. Ponieważ zawartość danego jonu będzie się wyrażała iloczynem długości strefy przez stężenie (przy stałym przekroju kapilary), to przy stałym stężeniu długość strefy determinuje zawartość substancji. Stężenie elektrolitu wiodącego wyznacza stężenia w poszczególnych strefach. Ilustruje to schemat przedstawiony na Rys. 5. 8 Rys. 5. Ilościowe oznaczenia metodą izotachoforezy XA, 2XA, 4XA – wprowadzone do kapilary ilości substancji; 1S, 2S, 4S – odpowiadająca im długość strefy zajętej przez XA; CA – stężenie substancji XA niezależne od wprowadzonej ilości. Rozdzielanie jonów na drodze kapilarnej izotachoforezy będzie tym lepszy im wyższa różnica ruchliwości, im dłuższa kapilara i im mniejsza objętość próbki i ilość jonów. Istnieją wzory umożliwiające obliczenie warunków rozdzielania. Brak rozdzielenia powoduje tworzenie się stref mieszanych. Znając efektywne ruchliwości jako funkcje pH można dobrać najbardziej odpowiedni bufor. Rozpatrzmy np. rozdzielanie jonów cytrynianowych i winianowych opierając się na rys. 6. Przy pH 6,5 rozdzielanie jest niemożliwy, bo krzywe się przecinają, natomiast odpowiednie jest pH poniżej 5. 9 Rys. 6. Ruchliwość jonów jako funkcja pH elektrolitu wiodącego zawierającego 0,01 M Cl- jako jonu wiodącego. 1 – chlorek, 2 – szczawian, 3 – cytrynian, 4 – winian, 5 – bursztynian, 6 – malonian, 7 – mrówczan, 8 – fosforan, 9 – węglan, 10 – octan, 11 – 2hydroksymaślan, 12 – dietylobarbituran. Czas potrzebny na przejście wiodącego anionu uL przez całą długość kapilary l można wyliczyć następująco: 1 vL t 1 uL E L 1s L iu L 1sFC L Z L (u L iu L uK ) gdzie s - powierzchnia przekroju kapilary, i - natężenie prądu, l - długość kapilary. To samo wyrażenie musi być spełnione dla każdej strefy długości l przechodzącej przez dany punkt w czasie t, n x F Z x (u x iu x uK ) W powyższym równaniu uwzględniono, że iloczyn Cx lxs = nx jest t Cx l x sF Z x (u x iu x uK ) substancji nx wprowadzonej do kapilary. 10 równy ilości moli Wartość t wyraża długość strefy w sekundach i jest proporcjonalna do wprowadzonej ilości nx i odwrotnie proporcjonalna do natężenia prądu, natomiast nie zależy od powierzchni przekroju kapilary. W kapilarnej izotachoforezie zastosowanie znalazły następujące detektory: Detektor przewodnościowy, a właściwie opornościowy. Jest to najczęściej stosowany uniwersalny detektor. Sygnał jest proporcjonalny do oporu elektrycznego. Izotachoferogram jest złożony ze schodków (Rys. 7a), których długości (szerokości) są proporcjonalne do ilości substancji, a względne wysokości hA/H, hB/H określają substancje jakościowo. Detektor UV (Rys. 7b) daje sygnał proporcjonalny do absorbancji przy 254 lub 280 nm. Uwidocznienie stref nie absorbujących jonów można osiągnąć za pomocą spejserów, tj. jonów absorbujących w UV, ustawiających się między strefami nie absorbujących jonów w UV. Jeżeli tworzą się strefy jonów o zbliżonej absorbancji można je rozdzielić przez wprowadzenie nie absorbujących spejserów. Detektor napięciowy mierzący gradient napięcia w strefach. Daje wykres podobny jak detektor przewodnościowy. Detektor termometryczny lub termiczny określa położenie stref na podstawie ich temperatury. Nadaje się do pracy w rozpuszczalnikach organicznych. Rys. 7. Izotachoforegramy otrzymane za pomocą detektora przewodnościowego (a) i detektora UV (b) w przypadku gdy aniony A i B wykazują absorbancji w UV-Vis. 11 ZADANIA 1. Oznaczanie F- w różnych rodzajach past do mycia zębów. 2. Oznaczanie PO43- w proszkach do prania. 3. Oznaczanie SO42-, NO3- w sokach. W celu doboru odpowiednich buforów musimy porównać ruchliwości oznaczanych anionów, a mianowicie Cl-, 79.1, NO3- 73.9, SO42- 76,3, cm2s-1v-110-5. Dla tych trzech anionów wpływ pH może być pominiety. Jon chlorkowy w stosowanych buforach stanowi jon wiodący. Trudność powoduje zbyt duże zbliżenie ruchliwości jonów Cl- i SO42-, co może prowadzić do stref mieszanych. Trudność tą można przezwyciężyć wprowadzając do buforu dwuwartościowe kationy, np. Cd2+, Ca2+, a również diaminy. Kationy te migrując w przeciwnym kierunku do anionów powodują ich przyhamowanie, przy czym efekt ten jest znacznie silniejszy w przypadku jonów dwuwartościowych. Zadowalające wyniki można uzyskać stosując bufor wiodący o składzie: -alanina 71 mg, 1,3-bis(tris)hydroxyethyl(metylamino)propan 85 mg, metylohydroksyetyloceluloza 50 mg, 5 ml 0.2 M kwas solny, wszystko rozcieńczamy wodą potrójnie destylowaną do 100 ml, pH 3,50. Jako bufor zakańczający można zastosować 0.01 M winian sodowo-potasowy. Powyższe bufory nadają się również do oznaczania fluorków i azotynów. W przypadku fosforanów (u = 33,3) należy zastosować inny bufor zakańczający, np. kwas nikotynowy. Oznaczenie chlorków można przeprowadzić na podstawie przyrostu czasu jaki upływa od rozpoczęcia analizy do wychylenia detektora. Czas ten jest proporcjonalny do całkowitej ilości chlorków, jakie przebywają drogę od wprowadzenia próbki do detektora. Przyrost czasu będzie proporcjonalny do dodatkowej ilości wprowadzonych chlorków. Oczywiście jony o podobnej ruchliwości jak jodkowe czy bromkowe dadzą ten sam efekt. W ramach zadania należy posługując się roztworami wzorcowymi wyznaczyć zależność między długością schodka a ilością wprowadzanego jonu i przeprowadzić analizę niektórych próbek. Mikropreparatywne rozdzielanie anionów. Wydzielenie określonych składników z mieszaniny po rozdzieleniu na drodze izotachoforezy można przeprowadzić w aparacie ZK2 według następującej metody. Przygotowujemy aparat do pracy przez wypełnienie zbiorników buforem zakańczającym (1, Rys. I) i wiodącym (10). W zbiorniku (20) pozostawiamy wodę. Wprowadzamy jako próbkę 12 jeden z anionowych barwników, np. arsenazo I, błękit bromofenolowy lub indygokarmin i rozpoczynamy pomiar w kolumnie 1, prąd 250 A. Po dotarciu barwnika do detektora (19) następuje wychylenie pisaka. Od tego momentu mierzymy czas stoperem aż do pojawienia się barwnika na skrzyżowaniu kapilar. Następnie mierzymy czas wyjścia barwnika z kapilary rozdzielczej, który powinien być równy czasowi wykazanemu przez rejestrator i drukarkę. Pomiary powtarzamy parokrotnie dla różnych barwników i ich mieszaniny. W przypadku mieszaniny bezbarwnych anionów postępujemy następująco. W jednej próbie wyznaczamy izotachoferogram i odpowiadające kolejnym schodkom czasy t1, t2, t3 itd. Jeżeli czas przejścia od detektora do rozwidlenia wynosi to, to pierwsza frakcja powinna znaleźć się w rozwidleniu po czasie to + t1, druga po czasie to+ t1 + t2 itd. Po upływie czasu to + t1 zatrzymujemy bieg procesu przez wciśniecie STOP, dozownik (7) ustawiamy w położenie ok 30 względem pionu, do przewodu (LE1) wkładamy strzykawkę bez tłoka, luzujemy zawory (12) i (17), po czym przez przewód (LE2) wprowadzamy ok. 0.5 ml buforu wiodącego, który po przepłynięciu przez kolumnę analityczną wymywa odpowiednią frakcję do przewodu (LE1), do strzykawki. Frakcję tą przenosimy do naczyńka, ustawiamy dozownik w pozycji pionowej i uruchamiamy proces przez wciśnięcie RUN. Po czasie t2 ponownie wciskamy STOP i całą operację powtarzamy. Frakcje zbieramy do osobnych naczyniek. 13