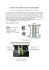analiza własności materiałów z przeznaczeniem na okładki
Transkrypt
analiza własności materiałów z przeznaczeniem na okładki
Monika Drabek Politechnika Częstochowska, Inżynieria Środowiska, specjalność: Inżynieria Energii ul. J. H. Dąbrowskiego 73, 42-200 Częstochowa, e-mail: [email protected] ANALIZA WŁASNOŚCI MATERIAŁÓW Z PRZEZNACZENIEM NA OKŁADKI NISKOTEMPERATUROWYCH OGNIW PALIWOWYCH Streszczenie Ogniwa paliwowe to jedne z najbardziej obiecujących urządzeń elektrochemicznych, służących do konwersji energii. Urządzenia tego typu przetwarzają energię chemiczną paliwa na energię elektryczną ze stosunkowo dużą sprawnością. Ogniwa paliwowe są powszechnie uznane za „czystą” i bezemisyjną technologię, stąd duże zainteresowanie rozwijaniem tej gałęzi nauki. Podstawowymi częściami konstrukcyjnymi ogniw paliwowych są: elektrody, elektrolit oraz okładki, zwane również interkonektorami. Reakcje elektrochemiczne zachodzą na powierzchni elektrod; wodór utlenia się na anodzie, a tlen ulega redukcji na katodzie, w oparciu o reakcje redoks. Elektrolit pełni funkcję przekaźnika protonów, uniemożliwiając przepływ elektronów. Okładki, stanowiące ponad 80% masy ogniwa, spełniają kilka ważnych funkcji, które opisano w niniejszej pracy. Uwzględniając agresywne środowisko panujące w celi ogniwa, niezmiernie ważnym jest dobór odpowiednich materiałów na poszczególne elementy wodorowych ogniw paliwowych. Od materiałów na okładki/interkonektory wymaga się przede wszystkim wysokiej odporności na korozję oraz odpowiednich właściwości mechanicznych. W ogniwach typu PEMFC (Proton Exchange Membrane Fuel Cell – ogniwa paliwowe z membraną protonowymienną), procesy korozyjne są intensyfikowane obecnością jonów pochodzących z membrany tj. F-, SO3-, SO4-. Przedmiotem pracy jest przedstawienie funkcji oraz wymogów stawianych materiałom przeznaczonym na okładki ogniw paliwowych. W artykule zaprezentowano metodykę badań odporności korozyjnej stali spiekanych, przeznaczonych na okładki. Analiza korozyjna została przeprowadzona dla stali austenitycznych: 304 LHD, 316 LHD, jak i stali ferrytycznej: 434LHC. Badania prowadzono w roztworze Na2SO4, zawierającym 2 ppm F- o pH=1, pH=3, pH=5 w temperaturach 20 oC i 80 oC. Wstęp Zanieczyszczenia powietrza stanowią główną przyczynę globalnych zagrożeń środowiska. Do związków zanieczyszczających atmosferę należą: dwutlenek węgla i siarki, tlenki azotu i pyły. Zgodnie z definicją WHO powietrze zanieczyszczone to takie, którego skład chemiczny może wpływać negatywnie na zdrowie człowieka, zwierząt, roślin lub też na inne elementy środowiska (woda, gleba). Skażenie powietrza jest szczególnie niebezpieczne ze względu na „mobilność” mas powietrza. Dzięki zjawisku dyfuzji w atmosferze zachodzi swobodne rozprzestrzenianie się zanieczyszczeń i transport na znaczne odległości. Do głównych źródeł zanieczyszczeń powietrza możemy zaliczyć: chemiczną konwersję paliw (w elektrowniach, elektrociepłowniach itp.), wydobycie i transport surowców, przemysł chemiczny (a także rafineryjny, metalurgiczny, cementowy), motoryzację. Niektóre z nich można ograniczać lub też całkowicie wyeliminować dzięki zastosowaniu nowoczesnych metod konwersji energii. Do takich właśnie należy technologia ogniw paliwowych. Ogniwa paliwowe niskotemperaturowe mogą z powodzeniem zastąpić małe mobilne generatory energii elektrycznej i ciepła. Sprawdzają się doskonale jako wytwornice prądu elektrycznego w silnikach hybrydowych samochodów osobowych (lub całkowicie elektrycznych) i dostawczych. Są świetnymi źródłami zasilania urządzeń elektronicznych tj.: komputery, telefony. Zastosowane jako małe, przydomowe generatory energii elektrycznej i ciepła (CHP), uniezależniają od ograniczeń dostaw prądu, wpływając na zmniejszenie emisji zanieczyszczeń z małych kotłowni. Aby w pełni rozwinąć technologię wodorową konieczne 1 jest, aby ogniwa paliwowe były tańsze, co jest związane z obniżeniem kosztów produkcji poszczególnych elementów generatorów. Z uwagi na agresywne środowisko pracy, elementy ogniw paliwowych muszą być wykonywane z materiałów wytrzymałych, o odpowiedniej odporności korozyjnej. W artykule zostaną opisane badania nad alternatywnymi, tańszymi materiałami, znajdującymi zastosowanie na elementy konstrukcyjne ogniw paliwowych. Zasada działania ogniwa paliwowego Działanie ogniwa paliwowego (a konkretnie wodorowego) opiera się na zjawisku elektrochemicznej konwersji paliwa, jakim jest gazowy wodór. Wodór podawany jest na anodę (-) ogniwa, gdzie ulega dysocjacji na kationy wodorowe i elektrony zgodnie z równaniem reakcji (1): 2H2→ 4H+ + 4e(1) Tworzące się w ten sposób elektrony zmierzają do katody poprzez zewnętrzny obwód elektryczny, powodując przepływ prądu w podłączonych do układu odbiornikach. Protony natomiast transportowane są przez selektywną membranę do katody. Na katodzie tlen reaguje z elektronami, tworząc aniony O2-: O2 + 4e-→ 2O2(2) Natomiast protony H+ są zobojętniane zjonizowanym tlenem: 2O2- + 4H+→ 2H2O (3) Końcowym produktem pracy ogniwa jest H2O w postaci ciekłej lub gazowej[1]. Rysunek 1. Budowa ogniwa paliwowego-schemat (rysunek zaczerpnięto z monografii: A. Dudek, R. Włodarczyk, Ogniwa paliwowe jako niekonwencjonalne źródła energii, Wydział Inżynierii Procesowej, Materiałowej i Fizyki Stosowanej, Politechnika Częstochowska) Niewątpliwą zaletą ogniw paliwowych jest to, że nie podlegają one ograniczeniom wynikającym z inżynierskiego ujęcia II zasady termodynamiki (silnik cieplny- silnik Carnota). Zatem sprawność ogniwa nie zależy od ilorazu temperatury górnego i dolnego źródła i może osiągać wartość nawet do 70%. Podstawowymi elementami budującymi pojedynczą celę niskotemperaturowego ogniwa paliwowego są: • elektrody (anoda i katoda), • elektrolit • okładki ogniwa (interkonektory, ang. – bipolar plate) 2 Najważniejszymi z punktu widzenia reakcji chemicznych są elektrody, bowiem na ich powierzchni zachodzą reakcje redoks 1 . Ze względu na skomplikowany i długoterminowy przebieg procesu syntezy wody na powierzchniach elektrod umieszcza się katalizator platynowy, obniżający poziom energii aktywacji, przyspieszając tym samym proces. Między elektrodami znajduje się elektrolit stały (w ogniwach niskotemperaturowych), w postaci membrany. Umożliwia on dyfuzję jonom H+, blokując transport elektronów i jonów tlenu pochodzących od katody. W powszechnie stosowanych ogniwach, jako elektrolit stosuje się między innymi produkt firmy DuPont o rynkowej nazwie NAFION®. Każdą celę ogniwa otwierają i zamykają interkonektory (okładki). Ich zadaniem jest: • równomierność rozprowadzenia paliwa i utleniacza, • przewodzenie prądu elektrycznego pomiędzy sąsiadującymi ze sobą celami, • odprowadzenie ciepła z ogniwa, • zapobieganie wychłodzeniu układu, • ograniczenie skali wycieku gazów reakcyjnych[2] Zdaniem autorów Hermann[3] oraz Mehta i Cooper[4], materiały stosowane na okładki powinny posiadać takie właściwości jak: - odpowiednią stabilność termiczną , odpowiednią gęstość(<5 g cm-3), porowatość około 13%, hydrofobowość, odpowiednie przewodnictwo cieplne oraz elektryczne , odporność na korozję (prąd korozyjny <0.016 mA cm-2) Dodatkowo materiał ten musi charakteryzować się dobrymi właściwości mechanicznymi. Wykonanie okładek jest więc kosztowne i pracochłonne. okładka ogniwa MEA=elektrody+elektrolit okładka ogniwa z widocznymi kanalikami Rysunek 2. Elementy składowe ogniwa paliwowego 1 Reakcje redoks- zachodzące równolegle utlenianie i redukcja 3 Wśród wielu materiałów stosowanych na okładki ogniw paliwowych znalazły się, między innymi, odlewy stali nierdzewnych, na powierzchni których perforowano kanaliki (jak na zamieszczonym zdjęciu). Kanaliki mają za zadanie równomierne rozprowadzenie gazowych czynników po powierzchni elektrod. Ich wykonanie jest bardzo precyzyjne przez co czaso- i pracochłonne. Wiele ośrodków naukowych na całym świecie prowadzi badania dotyczące wdrożenia nowych, prostszych technologii produkcji okładek ogniwa. Również Katedra Inżynierii Energii Wydziału Inżynierii i Ochrony Środowiska Politechniki Częstochowskiej podejmuje to zagadnienie. Prostsza i tańsza produkcja okładek, to niższa cena całego ogniwa, a więc i jego komercjalizacja. Cel i zakres badań Zważając na przytoczoną problematykę, niezbędne jest zbadanie możliwości zastosowania materiałów metalicznych na okładki ogniw paliwowych. Rozwiązaniem problemu wydają się być spiekane z proszków stale nierdzewne, dzięki niskim kosztom wytwarzania, oraz ich szczególnym własnościom. Ze względu na wymaganą odporność na korozję materiałów przeznaczonych na okładki ogniw paliwowych, zakres badań dotyczył określenia własności ochronnych materiałów spiekanych. W tym celu wyznaczono parametry korozyjne tj. Ekor- potencjał korozyjny, ikor – prąd korozyjny, określające szybkość korozji materiałów w danym środowisku. Właściwości materiałów spiekanych badano w urządzeniu zwanym potencjostatem. W celu dokładnego odzwierciedlenia warunków panujących w celi ogniwa zamodelowano skład i temperaturę roztworu. Jako roztwór referencyjny wybrano wodny roztwór siarczanu(VI) sodu- Na2SO4 o stężeniu 0,1 mol/dm3, zawierający 2 ppm anionów fluorkowych F-. Odczyn pH roztworu ustalono na poziomie równym 1, 3 oraz 5 (uwzględniając wzrost stężenia elektrolitu w trakcie pracy ogniwa, spowodowanego wzrastająca ilością kationów wodorowych). Badania prowadzono w temperaturze roztworu równej 293K i 353K. Materiał użyty do badań Materiał przeznaczony do analizy został przygotowany i wykonany przez firmę Höganäs z siedzibą w Szwecji. Badania prowadzono na rozpylanych wodą proszkach stali nierdzewnych: 304LHD, 316LHD oraz 434LHC. Ich skład chemiczny został przedstawiony poniżej Tablica 1. Skład chemiczny proszków użytych do badań: Gatunek proszku C[%] Mo[%] Ni[%] Cr[%] Si[%] Mn[%] Fe[%] 1. 304LHD 0,013 - 11,2 18,9 0,9 0,1 reszta 2. 316LHD 0,025 2,2 12,3 16,7 0,9 0,1 reszta 3. 434LHC 0,015 0,98 - 16,2 0,8 0,1 reszta Lp. Proszki poddano prasowaniu (a następnie chłodzeniu na powietrzu) przy zastosowaniu obciążenia odpowiednio: 705MPa, 700MPa oraz 765MPa oraz spiekaniu w temperaturze 4 1250oC w czasie 30 minut, w atmosferze amoniaku (poprawiającym właściwości antykorozyjne spieku). Rysunek 3. Mikrostruktury spieków wykonano przy zastosowaniu skaningowego mikroskopu elektronowego JOEL Model JSM-5400 , powiększenie x500: a) spiek 304LHD, b) spiek 316LHD,c)spiek 434LHC Obecność dodatków w postaci Cr, Mo, Ni wpływa na poprawę właściwości korozyjnych stali. Z załączonej tabeli wynika, że największy dodatek komponentów posiada próbka stali nierdzewnej 316LHD. Obserwując zdjęcia mikrostruktury spieków (wykonane skaningowym mikroskopem elektronowym) można zauważyć, że to właśnie próbka „b” odznacza się najbardziej jednorodną strukturą. Można zatem przypuszczać, że to ona będzie posiadała najlepsze właściwości korozyjne Stanowisko pomiarowe Oznaczenie korozyjności materiałów wykonywano w urządzeniu zwanym potencjostatem. Najważniejszym elementem potencjostatu jest cela pomiarowa, w skład której wchodzą trzy elektrody zanurzone w elektrolicie. Jedną z elektrod stanowi badana próbka (elektroda robocza), drugą jest elektroda odniesienia (w naszym przypadku platynowy drucik), trzecia elektroda to kalomelowa elektroda odniesienia (nasycona elektroda kalomelowa NEK). przeciwelektrodadrucik Pt elektroda-badana próbka elektroda porównawcza-kalomelowa NEK Rysunek 4. Schemat celi pomiarowej potencjostatu 5 Efekt pracy potencjostatu Efektem pracy potencjostatu jest tzw. krzywa polaryzacji. Krzywa przedstawia zależność funkcyjną potencjału (na osi odciętych) i gęstości prądu (na osi rzędnych). Gęstość prądu anodowego [A/cm2] krzywa polaryzacji metalu z aktywnym roztwarzaniem ipk krzywa polaryzacji metalu pasywującego się iF 1 ip 2 stan stan stan aktywny przejściowy pasywny Ekor Ep=EF Eak Eprz Etr Potencjał [V] Rysunek 5. Krzywe polaryzacji metali roztwarzających się i ulegających pasywacji. Potencjały: Ekor- korozyjny, Ep- pasywacji, Ef- Flady’ego, Eak- aktywacji, Eprz- przebicia, Etr- transpasywacji, ip- prąd pasywacji, ipk- prąd początku pasywacji, 1- zakres korozji wżerowej, 2- zakres korozji ogólnej Krzywą polaryzacji można podzielić na dwa zasadnicze elementy: polaryzację katodową i polaryzację anodową. Z punktu widzenia prowadzonych badań ważniejszym jest odcinek polaryzacji anodowej. Obserwując jej przebieg można określić w jaki sposób zachowuje się materiał umieszczony w środowisku korozji. Zatem możemy mówić o krzywej polaryzacji metalu pasywującego się 2 , oraz o krzywej polaryzacji metalu aktywnie roztwarzającego się w elektrolicie. Najważniejszymi punkami wykresu są potencjał korozji Ekor i prąd korozji ikor. Potencjał korozji odczytujemy bezpośrednio z wykresu, natomiast prąd korozji wyznaczany jest w następujący sposób (rysunek 6): na krzywych potencjodynamicznych przeprowadzono odcinek styczny do prostoliniowego odcinka części katodowej (odcinek polaryzacji katodowej). Styczna o nachyleniu 118mV/dekadę (przyjęte nachylenie jest stosowane dla 2 Pasywacja to proces wytwarzania przez niektóre grupy substancji warstw ochronnych (powłok pasywnych). Powłoka ta jest produktem utworzonym na skutek reakcji chemicznych jakie zachodzą pomiędzy materiałem a otoczeniem. O zjawisku pasywacji mówi się wtedy, gdy powstająca na powierzchni metalu warstwa jest całkowicie odporna na dalsze reakcje, zachodzące w tym środowisku, a jednocześnie musi być na tyle szczelna aby stanowić warstwę ochronną przed innymi składnikami biorącymi udział w procesie. 6 czystego żelaza a także stali w temperaturze 25oC) przecina prostą równoległą do osi prądów, wychodzącą z punktu odpowiadającemu potencjałowi korozyjnemu na osi potencjałów. Miejsce przecięcia obu prostych wyznacza wartość prądową, uznaną za wartość prądu korozyjnego (mA cm-2)[5]. Rysunek 6. Przyjęty w pracy sposób wyznaczania potencjału korozji i prądu korozji z krzywych potencjodynamicznych (Zaczerpnięto z R.Włodarczyk, Własności antykorozyjne kompozytowych powłok na bazie polipirolu wytwarzanych na pasywujących się podłożach, Rozprawa doktorska, Częstochowa 2003, str. 48) Wyniki badań i ich dyskusja Zamieszczone wykresy przedstawiają wyniki badań korozyjności próbek spiekanych stali nierdzewnych. Na każdym z wykresów zestawiono próbki w taki sposób, aby możliwe było szybkie porównanie. Ze względu na duże wahania wartości ustalono skalę logarytmiczną na osi gęstości prądu. W celu określenia wpływu składu materiału na odporność korozyjną stali spiekanych, zarejestrowano krzywe polaryzacji w roztworze Na2SO4+2 ppm F-, w temperaturze 293K pH=1 (rys. 7a), pH=3 (rys. 7b), pH=5 (rys. 7c). Skład materiału wpływa na wartość potencjału korozji. W roztworze o pH=1, materiały spiekane ulegają pasywacji, o czym świadczy gwałtowny spadek wartości prądowych w zakresie potencjału od 0.0 V do 1.0V wzgl. NEK. Po przekroczeniu napięcia 1.0 V, następuje gwałtowny wzrost prądu związany z przebudowywaniem warstwy pasywnej lub wydzielaniem tlenu. Podobna sytuacja ma miejsce w przypadku pH=3 oraz pH=5 (rysunek 7b i 7c). Obserwujemy tu spadek wartości prądu dla tych samych zakresów potencjału (0.0 –1.0V wzgl. NEK). Spośród trzech próbek, badanych w temperaturze 293K, największym potencjałem i najniższym prądem korozji charakteryzuje się 316LHD. Zatem próbka ta posiada najlepsze właściwości korozyjne. Przyczyn można dopatrywać się w komponentach Mo, Ni, Cr, których spiek 316LHD posiada najwięcej. 7 Current density/mA cm -2 Poprawiają one strukturę spieku, czyniąc ją bardziej jednorodną i odporną na agresywne środowisko. 10 2 10 1 10 0 10 -1 10 -2 0.1M Na2SO4, 2ppm F pH=1, T=293K - 304LHD 316LHD 434LHC a -0.5 0.0 0.5 1.0 1.5 2.0 Potential/ V vs. SCE 10 2 10 1 10 0 Current density/mA cm -2 - 10 -1 10 -2 10 -3 10 -4 0.1M Na2SO4, 2ppm F pH=3, T=293K 304 LHD 316 LHD 434 LHC b -0.5 0.0 0.5 1.0 1.5 2.0 Potential/ V vs. SCE 8 10 2 10 1 10 0 - Current density/mA cm -2 0.1M Na2SO4, 2ppm F pH=5, T=293K 10 -1 10 -2 10 -3 10 -4 304LHD 316LHD 434LHC c -0.5 0.0 0.5 1.0 1.5 2.0 Potential/ V vs. SCE Rysunek 7. Krzywe polaryzacji próbek: a) 304LHD,b) 316LHD,c) 434LHC, badane w roztworze Na2SO4 (+2ppm F-) w temperaturze T=293K W celu określenia wpływu temperatury pracy ogniwa na intensywność procesów korozyjnych, zarejestrowano krzywe potencjokinetyczne w temperaturze 353K. Wiadome jest, że ze wzrostem temperatury wzrasta szybkość procesów degradacji materiałów. Jednakże, ze wzrostem temperatury maleje też rozpuszczalność tlenu, czynnika odpowiedzialnego za utlenianie materiału. Przebieg krzywej potencjokinetycznej wykazuje podobny charakter zarówno w temperaturze 293K, jak i w temperaturze 353K. Przy pH=1 obserwuje się wyraźny pasywny przebieg w zakresie potencjałów 0.0 V do 1.0 V wzgl. NEK. Dla pH=3 oraz pH=5 obserwuje się nieco mniej wyraźny, aczkolwiek obecny pasywny przebieg. 10 3 10 2 10 1 10 0 - Current density/mA cm -2 0.1M Na2SO4, 2ppm F pH=1, T=353K 10 -1 10 -2 304 LHD 316 LHD 434 LHC d -0.5 0.0 0.5 1.0 1.5 2.0 Potential/ V vs. SCE 9 2 10 Current density/mA cm -2 - 0.1M Na2SO4, 2ppm F pH=3, T=353K 1 10 0 10 -1 10 -2 10 304 LHD 316 LHC 434 LHC -3 10 e -4 10 -0.5 0.0 0.5 1.0 1.5 2.0 Potential/ V vs. SCE 2 10 1 10 0 Current density/mA cm -2 10 10 -1 10 -2 10 -3 10 -4 0.1M Na2SO4, 2ppm F pH=5, T=353K 304 LHD 316 LHD 434 LHC f -0.5 - 0.0 0.5 1.0 1.5 2.0 Potential/ V vs. SCE Rysunek 8. Krzywe polaryzacji próbek: d) 304LHD, e)316LHD, f)434LHC, badane w roztworze Na2SO4 (+2ppm F-) w temperaturze T=353K Tabela zestawia wartości potencjału i prądu korozji próbek, w zależności od pH i temperatury roztworu Tablica 2. Wartości potencjału i prądu korozji pH 1 Ekor [V] ikor [mA cm-2] 304LHD 0.1mol dm-3 Na2SO4+2ppmF- -0.35 0.600 316LHD 0.1mol dm-3 Na2SO4+2ppm F- -0.30 0.200 T[K] Materiał 293 293 Roztwór 10 -0.42 0.020 -0.40 0.010 304LHD 0.1mol dm-3 Na2SO4+2ppm F- 293 316LHD 0.1mol dm-3 Na2SO4+2ppm F- 293 -3 434LHC 0.1mol dm Na2SO4+2ppm F 293 304LHD 0.1mol dm-3 Na2SO4+2ppm F- 293 -3 316LHD 0.1mol dm Na2SO4+2ppm F 293 -3 434LHC 0.1mol dm Na2SO4+2ppm F 353 -3 304LHD 0.1mol dm Na2SO4+2ppm F 353 316LHD 0.1mol dm-3 Na2SO4+2ppm F- -0.52 8.000 353 434LHC 0.1mol dm-3 Na2SO4+2ppm F- -0.30 1.200 -0.41 0.200 353 5 2.300 293 5 3 -0.50 434LHC 3 1 0.1mol dm-3 Na2SO4+2ppm F- 293 304LHD -3 0.1mol dm Na2SO4+2ppm F - -0.49 -0.24 -0.26 -0.51 0.028 0.010 0.010 0.015 1.500 -0.32 353 316LHD 0.1mol dm-3 Na2SO4+2ppm F- -0.50 0.190 353 434LHC 0.1mol dm-3 Na2SO4+2ppm F- -0.40 0.080 353 304LHD 0.1mol dm-3 Na2SO4+2ppm F- 353 316LHD 0.1mol dm-3 Na2SO4+2ppm F- -0.50 0.015 353 434LHC 0.1mol dm-3 Na2SO4+2ppm F- -0.29 0.028 -0.51 0.050 11 Rysunek 9. a)spiek 304LHD, b) spiek 316LHD, c)spiek 434LHC. Próbki badano w środowisku roztworu Na2SO4 z dodatkiem 2 ppm F-, przy pH=1 i w temperaturze 353K Wnioski Badania prowadzone w roztworze o temperaturze 293K pokazują, że najlepszymi właściwościami korozyjnymi charakteryzuje się próbka 316 LHD. Przebieg krzywych w zakresie anodowym wskazuje, że na powierzchni badanych próbek zachodzi zjawisko pasywacji i pasywacja ta jest tym silniejsza, im wyższe pH roztworu. Procesy korozyjne przebiegają najintensywniej i najszybciej w podwyższonej temperaturze elektrolitu (rysunek 8). Na rysunku 9 zostały przedstawione ubytki w materiale, spowodowane korozją wżerową. Zdjęcia próbek pokorozyjnych wykonano przy użyciu mikroskopu optycznego o stukrotnym powiększeniu. Widać na nich, że stale 304 i 316 LHD zachowały ciągłość struktury, natomiast na stali ferrytycznej widać wyraźne korozyjne wżery. Przyczyn można dopatrywać się właśnie w obecności dodatków Mo, Cr, Ni i bardziej jednorodnej strukturze spieków austenitycznych, porównaniu z ferrytycznymi. Podsumowanie 1. 2. 3. 4. 5. 6. Parametry korozyjne określające możliwość wykorzystania materiałów spiekanych na okładki ogniw paliwowych stanowią jeden z etapów doboru materiałów na te elementy. Do grupy wielu materiałów wykorzystywanych dotychczas na okładki ogniw paliwowych można dołączyć również materiały spiekane proszków stali nierdzewnych, Stale 304LHD oraz 316LHD posiadały strukturę austenityczną- jednorodną, natomiast stal 434LHC ferrytyczną, Na podstawie przeprowadzonych badań właściwości korozyjnych obserwuje się wyraźny wpływ pH i temperatury środowiska na intensywność procesów roztwarzania (korozji) materiałów, Spieki o dobrych właściwościach korozyjnych charakteryzują się wysokim potencjałem korozji i niskim prądem korozji (zależność obowiązuje dla temperatury elektrolitu 293K) Dodatek niewielkiej ilości komponentów, w postaci Cr, Mo, Ni poprawia właściwości 12 antykorozyjne stali Wykonane badania i analizy spiekanych stali nierdzewnych wskazują na możliwość zastosowania tych materiałów na elementy konstrukcyjne ogniw paliwowych. Odpowiednia porowatość oraz własności strukturalne analizowanych materiałów, spełniają podstawowe wymagania nałożone na interkonektory generatorów energii elektrycznej i ciepła. Warunkiem podstawowym zakwalifikowania technologii wytwarzania materiałów spiekanych na elementy okładek paliwowych jest zoptymalizowanie własności strukturalnych i mechanicznych z odpornością na korozję w warunkach pracy ogniwa paliwowego. Literatura [1] J.Larminie, Fuel cell system explained, SAE International, Secound Edition, May 2003 [2] R.Włodarczyk, Sintered Materials for Bipolar Plate, Częstochowa University of Technology, Department of Energy Engineering, Częstochowa 2009 [3] Hermann A., Chaudhuri T., Spagnol P., Bipolar plates for PEM fuel cells: A review, Int. J. Hydrogen Energy, vol. 30 (2005), p.1297. [4] Mehta V., Cooper J.S., Review and analysis of PEM fuel cell design and manufacturing, J. Power Sources, vol. 114 (2003), p. 32. 13