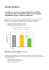czytaj PDF - Endokrynologia Pediatryczna
Transkrypt
czytaj PDF - Endokrynologia Pediatryczna
Vol. 5/2006 Nr 2(15) Endokrynologia Pediatryczna Pediatric Endocrinology Czy acanthosis nigricans może być markerem zespołu metabolicznego u dzieci z otyłością prostą? Is acanthosis nigricans useful as a clinical marker of metabolic syndrome in obese children? 1 Barbara Garanty-Bogacka, 1Małgorzata Syrenicz, 2Krystyna Wójcik, 2Mieczysław Walczak 1 Samodzielna Pracownia Propedeutyki Chorób Dzieci Pomorskiej Akademii Medycznej w Szczecinie II Klinika Chorób Dzieci Pomorskiej Akademii Medycznej w Szczecinie 2 Adres do korespondencji: Barbara Garanty-Bogacka, Samodzielna Pracownia Propedeutyki Chorób Dzieci PAM, ul. Unii Lubelskiej 1, 21-252 Szczecin, e-mail: [email protected] Słowa kluczowe: acanthosis nigricans, zespół metaboliczny, dzieci, otyłość Key words: acanthosis nigricans, metabolic syndrome, children, obesity STRESZCZENIE/ABSTRACT Zmiany skórne o typie rogowacenia ciemnego (acanthosis nigricans) są często spotykane u młodych ludzi z otyłością prostą i przez licznych badaczy uważane za łatwo rozpoznawalny, kliniczny objaw insulinooporności i zagrożenia wystąpieniem cukrzycy typu 2. Celem badań była ocena częstości występowania rogowacenia ciemnego u dzieci otyłych z cechami zespołu metabolicznego (ZM) oraz określenie związku pomiędzy rogowaceniem ciemnym a poszczególnymi parametrami ZM. Materiał i metody. Badaniami objęto 578 dzieci z otyłością prostą, w wieku 6–18 lat. U badanych przeprowadzono pomiary wysokości i masy ciała, obwodu pasa, zawartości tkanki tłuszczowej (metodą bioimpedacji). Rogowacenie ciemne rozpoznano na postawie badania klinicznego. U badanych oznaczono w surowicy krwi w warunkach podstawowych poziomy glukozy, insuliny, cholesterolu i triglicerydów oraz wykonano 24-godzinny ambulatoryjny pomiar ciśnienia tętniczego. Zespół metaboliczny (ZM) rozpoznano według kryteriów ATP III, w modyfikacji Ferrantiego i wsp. Korelacje pomiędzy występowaniem acanthosis nigricans a parametrami zespołu metabolicznego obliczono testem korelacji rang Spermana. Wyniki. Rogowacenie ciemne rozpoznano u 164 (28,4%) dzieci z otyłością prostą. W tej grupie cechy ZM wykazywało 152 (92,7%) dzieci. Spośród parametrów ZM najsilniejszy związek z rogowaceniem ciemnym wykazywały: ciśnienie tętnicze skurczowe (R = 0,23; p < 0,001), obwód pasa (R = 0,21; p < 0,001), stężenie triglicerydów (R = 0,20; p < 0,001), ciśnienie tętnicze rozkurczowe (R = 0,17; p < 0,001) oraz stężenie cholesterolu HDL (R = –0,15; p < 0,01). Wnioski. Stwierdzenie rogowacenia ciemnego u dziecka z otyłością wskazuje na konieczność przeprowadzenia szczegółowych badań w kierunku obecności zespołu metabolicznego. Endokrynol. Ped., 5/2006;2(15):49-55 Since the presence of acanthosis nigricans (AN) in young people is commonly associated with obesity, the use of AN as a clinical surrogate of laboratory-documented hyperinsulinemia has been proposed for early detection of individuals prone to develop type 2 diabetes. The goal of the study was to determine the prevalence of AN in obese Vol. 5/2006, Nr 2(15) 49 Praca oryginalna Endokrynol. Ped., 5/2006;2(15):49-55 children with metabolic syndrome (MS) as well as to assess the relationship between AN and selected parameters of MS. Material and methods. A total of 578 obese children and adolescents, aged 6 018 years were evaluated. Measurements of weight, height, waist circumference, body fat content (by bioimpedance method) were performed. Acanthosis nigricans was recognized by clinical evaluation. Fasting glucose, insulin, cholesterol and triglycerides were determined in blood samples. 24-h ambulatory blood pressure monitoring were also performed. Metabolic syndrome was determined according to the ATP III criteria with a modification by Ferranti et al. To assess the association between AN and metabolic syndrome parameters, the rang Spearman correlation test was performed. Results. AN was recognized in 164 (28.4%) children. In this group, MS was revealed in 152 (92.7%) patients. The presence of AN correlated with systolic blood pressure (R = 0.23; p < 0.001), waist circumference (R = 0.21; p < 0.001), triglycerides in serum (R = 0.20; p < 0.001), diastolic blood pressure (R = 0.17; p < 0.001), and HDL cholesterol level’s (R = 0.15; p < 0.01). Conclusions. Acanthosis nigricans may be useful as early indicator of metabolic syndrome in obese children. Pediatr. Endocrinol., 5/2006;2(15):49-55 Wstęp Terminem „zespół metaboliczny” określa się nagromadzenie czynników ryzyka chorób sercowo-naczyniowych, których podłożem patogenetycznym jest najprawdopodobniej insulinooporność i hiperinsulinemia, zależne zarówno od czynników genetycznych, jak i środowiskowych [1]. Wyodrębnienie zespołu metabolicznego zaproponował w r. 1988 G. Reaven [2], wskazując, że tworzy go jednoczesne występowanie otyłości brzusznej, hiperglikemii, nadciśnienia tętniczego i dyslipidemii pod postacią hipertriglicerydemii oraz obniżenia HDL-cholesterolu. W późniejszych latach do zespołu dodano wiele innych zaburzeń i czynników ryzyka sercowo-naczyniowego, jak np. mikroalbuminuria, zwiększenie tendencji prozakrzepowych, zmniejszenie aktywności fibrynolitycznej, nasilenie mechanizmów oksydacyjnych w komórkach, stan zwiększonej aktywacji prozapalnej [3]. Spośród licznych definicji i kryteriów rozpoznawania zespołu metabolicznego najczęściej (zarówno w badaniach epidemiologicznych, jak i praktyce lekarskiej) stosuje się definicję zaproponowaną przez WHO [4] oraz kryteria III Raportu Narodowego Programu Edukacji Cholesterolowej (NCEP) na temat Wykrywania, Oceny i Leczenia Wysokiego Poziomu Cholesterolu u Dorosłych (Adult Treatment Panel III, ATP III) [5]. Opracowanie tych kryteriów umożliwiło rozwój badań epidemiologicznych dotyczących częstości występowania i charakterystyki zespołu w różnych populacjach ludzi dorosłych [6, 7]. Badania te dostarczyły nowych dowodów na znaczenie zespołu metabolicznego jako jednostki, której rozpoznanie wiąże się z większym ryzykiem rozwoju cukrzycy typu 2 [7] i chorób sercowo-naczyniowych [8], a także ze zwiększoną śmiertelnością z powodu tych chorób [8]. Wyniki badań przeprowadzonych u dorosłych w zestawieniu z na50 rastającą epidemią otyłości u dzieci zwiększyły zainteresowanie zespołem metabolicznym w pediatrii, bowiem otyłość, która jest główną przyczyną insulinooporności u dzieci, związana jest z częstszym występowaniem dyslipidemii [9], cukrzycy typu 2 [10] i powikłań naczyniowych [11]. Ponieważ, jak wykazano, niektóre elementy zespołu metabolicznego, takie jak nieprawidłowe parametry lipidowe i podwyższone ciśnienie tętnicze, występują zarówno u dzieci, zwłaszcza otyłych, jak i u dorosłych, wczesne rozpoznanie współwystępowania czynników ryzyka w dzieciństwie może być przydatne w zapobieganiu rozwojowi chorób powszechnie określanych mianem cywilizacyjnych. Do tej pory nie opracowano jednak ścisłych kryteriów diagnostycznych zespołu metabolicznego dla populacji dziecięcej. Największe zastosowanie mają kryteria zespołu opracowane przez Ferranti i wsp. [12] na podstawie kryteriów ATP III [5]. Oprócz trudności związanych z opracowaniem ujednoliconej definicji zespołu metabolicznego dla dzieci i młodzieży kolejnym problemem jest znalezienie u dzieci otyłych łatwo rozpoznawalnego objawu klinicznego, który mógłby jako test przesiewowy wyodrębnić grupę dzieci wymagającą szczególnie pilnej diagnostyki w kierunku obecności zespołu metabolicznego. W obecnej pracy postanowiono sprawdzić, czy takim objawem może być rogowacenie ciemne (acanthosis nigricans) stwierdzane u wielu dzieci z otyłością. Rogowacenie ciemne jest zmianą skórną, charakteryzującą się układowo występującymi ogniskami przebarwienia i brodawkowania skóry na ograniczonych obszarach, głównie na szyi, karku, w dołach pachowych, łokciowych i podkolanowych, a niekiedy w okolicy oczu i ust oraz narządów płciowych. Wystąpienie rogowacenia ciemnego jest najprawdopodobniej spowodowane przez czynnik stymulujący keratynocyty i fibroblasty skóry, który działa poprzez trzy różne receptory komór- Garanty-Bogacka B. i inni – Czy acanthosis nigricans może być markerem zespołu metabolicznego u dzieci z otyłością prostą? kowe: czynnika wzrostu naskórka, insulinopodobnego czynnika wzrostowego-1 i czynnika wzrostu fibroblastów, które należą do nadrodziny receptorów kinazy tyrozyny [13]. Rogowacenie ciemne rzekome jest stosunkowo często spotykaną zmianą skórną u dzieci i młodzieży. Stuart i wsp. [14] na podstawie badań przeprowadzonych u 1400 nastolatków, uczęszczających do szkół publicznych w Galveston, stwierdzili rogowacenie ciemne u 5–40% uczniów, z wyraźną przewagą Afroamerykanów. W badaniach tych potwierdzono również wyraźny związek pomiędzy acanthosis nigricans i otyłością – ponad 60% uczniów otyłych wykazywało zmiany skórne o typie rogowacenia ciemnego. Prospektywne badania tych samych autorów, obejmujące ponad siedem tysięcy dzieci, wykazały, że częstość występowania rogowacenia ciemnego skojarzonego z otyłością jest niska w pierwszych trzech latach życia, wzrasta w okresie wczesnego dzieciństwa aż do okresu pokwitania, po czym utrzymuje się na względnie stałym poziomie. Autorzy podkreślają, że chociaż rogowacenie ciemne rzekome jest związane z otyłością, ponad jedna trzecia badanych dzieci z acanthosis nigricans nie była otyła, jednakże nawet te dzieci miały większą masę ciała i wyższy poziom insuliny w porównaniu z dziećmi bez zmian skórnych. Dane te potwierdzają, że hiperinsulinemia, najczęściej związana z nadmiarem masy ciała, ma zasadnicze znaczenie w rozwoju rogowacenia ciemnego rzekomego. Celem pracy była ocena częstości występowania rogowacenia ciemnego u dzieci otyłych z cechami zespołu metabolicznego oraz określenie związku pomiędzy rogowaceniem ciemnym a poszczególnymi parametrami zespołu. Materiał i metody Badaniami objęto 578 dzieci z otyłością prostą, w wieku od 6 do 18 lat. U badanych przeprowadzono pomiary wysokości i masy ciała (z obliczeniem wskaźnika Body Mass Index – BMI) oraz obwodu pasa, zgodnie z obowiązującą metodyką [15]. Procentową i bezwzględną zawartość tkanki tłuszczowej w organizmie oceniono metodą bioimpedancji z zastosowaniem aparatu Tanita 131. Otyłość rozpoznano na podstawie wartości BMI > 97 centyla na siatkach centylowych dla wieku i płci [15]. Pomiarów obwodu pasa dokonano także u 342 dzieci z prawidłową masą ciała, w wieku od 6 do 18 lat (grupa kontrolna). Obwód pasa w tej grupie, przekraczający 75 centyl stanowił punkt odniesie- nia dla grupy badanej. Obwód pasa chłopców z grupy kontrolnej wynosił od 48,0 cm do 90,5 cm, średnio 63,4 ± 10,8 cm. Obwód pasa chłopców w zakresie od 63,8 do 76,4 cm (zależnie od wieku i stadium dojrzewania płciowego) stanowił 75 centyl. Obwód pasa dziewcząt z grupy kontrolnej wynosił od 49,0 cm do 80,0 cm, średnio 62,1 ± 11,1 cm. Obwód pasa dziewcząt w zakresie od 65,2 do 74,8 cm stanowił 75 centyl w zależności od wieku i stadium dojrzewania płciowego. Rogowacenie ciemne u dzieci z otyłością rozpoznano na podstawie badania przedmiotowego. Krew do badań biochemicznych pobierano na czczo, po 12-godzinnej przerwie nocnej. Stężenie glukozy mierzono metodą oksydazową (Glucose HK, Olympus), natomiast insuliny – metodą MEIA z użyciem zestawów AxSYM Insulin f-my Abbott. Stężenie cholesterolu frakcji HDL oznaczono metodą immunoinhibicji (analizator Olympus), zaś triglicerydów metodą enzymatyczną (analizator Olympus). U wszystkich badanych przeprowadzono ambulatoryjne monitorowanie ciśnienia tętniczego krwi (metodą oscylometryczną, Mobil-O-Graph–rekorder) według protokołu: pomiar ciśnienia tętniczego w godzinach dziennych (6:00–22:00) co 30 minut, pomiary w godzinach nocnych co 60 minut. Z analizy wyłączono pomiary, w których odczyt wynosił 0 mm Hg oraz pomiary, w których różnica pomiędzy ciśnieniem skurczowym i rozkurczowym była mniejsza niż 10 mm Hg. Nadciśnienie tętnicze rozpoznano u dzieci, u których wartości średnie dobowego ciśnienia skurczowego i/lub rozkurczowego przekraczały 90 centyl dla płci i wzrostu [16], przy jednoczesnym wykluczeniu innych przyczyn podwyższonego ciśnienia tętniczego. Analizy statystyczne przeprowadzono przy użyciu pakietu STATISTICA PL. Badane parametry o rozkładzie nieparametrycznym były przekształcane logarytmicznie. W ocenie statystycznej posłużono się testem nieparametrycznym U Manna-Whitneya oraz testem korelacji rang Spearmana. Za istotne statystycznie uznano różnice, dla których p < 0,05. Wyniki badań Rogowacenie ciemne rozpoznano u 164 (28,4%) badanych dzieci. Zmiany skórne zlokalizowane były najczęściej na szyi (93% przypadków) i w dołach pachowych (75% przypadków). U ośmiorga dzieci stwierdzono rogowacenie ciemne obejmujące również pachwiny oraz okolicę pępka. 51 Praca oryginalna Endokrynol. Ped., 5/2006;2(15):49-55 W grupie dzieci ze zmianami skórnymi o typie acanthosis nigricans kryteria zespołu metabolicznego (≥ 3) wg Ferranti i wsp. [12] (tab. I) spełniało 152 (92,7%) dzieci. Wartości wszystkich analizowanych parametrów, z wyjątkiem glikemii na czczo, różniły się w sposób istotny statystycznie pomiędzy dziećmi z rogowaceniem ciemnym, spełniającymi dodatkowo Tabela I. Kryteria zespołu metabolicznego u dzieci, zaproponowane przez Ferranti i wsp. Table I. Diagnostic criteria of metabolic syndrome in children, proposed by Ferranti et al. Hipertriglicerydemia Niski poziom HDL-cholesterolu u chłopców w wieku 15-19 lat ≥ 1,1 mmol/L < 1,3 mmol/L < 1,17 mmol/L Hiperglikemia na czczo ≥ 6,1 mmol/L Obwód pasa > 75 centyla dla wieku i płci Nadciśnienie tętnicze > 90 centyla dla wieku, płci i wzrostu Ryc. 1. Częstość występowania poszczególnych elementów zespołu metabolicznego u dzieci w zależności od płci Fig. 1. Prevalence estimates of individual metabolic abnormalities, shown by gender Najczęściej stwierdzanymi zaburzeniami były: hipertriglicerydemia – 82 (53,9%) dzieci i otyłość brzuszna – 77 (50,6%) dzieci. Niski poziom HDLcholesterolu stwierdzono u 53 (34,8%) badanych, natomiast nadciśnienie tętnicze u 24 (15,8%) dzieci. U trojga (1,9%) badanych poziom glukozy na czczo przekraczał 6,1 mmol/L (ryc. 1). W tabeli II przedstawiono wyniki badań auksologicznych i biochemicznych oraz wartości ciśnienia tętniczego u dzieci z acanathosis nigricans (AN) i zespołem metabolicznym (ZM) oraz dzieci otyłych niewykazujących tych zaburzeń. 52 kryteria zespołu metabolicznego a dziećmi wolnymi od obu tych nieprawidłowości. W tabeli III przedstawiono wartości współczynników korelacji pomiędzy rogowaceniem ciemnym a poszczególnymi parametrami zespołu metabolicznego. Spośród parametrów zespołu metabolicznego najsilniejszy związek z obecnością rogowacenia ciemnego wykazywały: ciśnienie tętnicze skurczowe, obwód pasa, stężenie triglicerydów i ciśnienie tętnicze rozkurczowe. Nie stwierdzono zależności pomiędzy rogowaceniem ciemnym a poziomem glukozy na czczo. Garanty-Bogacka B. i inni – Czy acanthosis nigricans może być markerem zespołu metabolicznego u dzieci z otyłością prostą? Tabela II. Charakterystyka kliniczna i biochemiczna badanych dzieci Table II. Clinical and biochemical characteristics of studied children Dzieci z AN i MS Dzieci bez AN i MS 152 414 Chłopcy/dziewczynki 218/196 80/72 Cecha X ± SD X ± SD p Wiek 12,3 ± 2,8 11,8 ± 3,1 NS Masa ciała (kg) 73,6 ± 21,7 65,3 ± 19,5 < 0,001 Wysokość (cm) 156,8 ± 14,9 152,6 ± 16,6 < 0,01 BMI (kg/m2) 29,2 ± 4,7 27,3 ± 3,7 < 0,001 SDS-BMI 3,70 ± 1,59 3,20 ± 1,34 < 0,001 Tkanka tłuszczowa (%) 35,1 ± 5,9 32,5 ± 6,2 < 0,001 Tkanka tłuszczowa (kg) 26,1 ± 10,5 21,5 ± 8,2 < 0,001 Obwód pasa (cm) 97,2 ± 12,8 91,2 ± 11,6 < 0,001 Glukoza (mmol/L) 5,0 ± 0,6 4,8 ± 0,6 NS Insulina (pmol/L) 156,2 ± 99,7 104,5 ± 61,7 < 0,001 HDL-cholesterol (mmol/L) 1,26 ± 0,33 1,34 ± 0,31 < 0,01 Triglicerydy (mmol/L) 1,45 ± 0,74 1,20 ± 0,71 < 0,001 RR skurczowe (mm Hg) 114,5 ± 9,5 110,2 ± 8,8 < 0,01 RR rozkurczowe (mm Hg) 64,6 ± 7,0 62,2 ± 6,6 <0,05 Liczba Tabela III. Współczynniki korelacji rogowacenia ciemnego (AN) i elementów zespołu metabolicznego Table III. Correlation coefficients of acanthosis nigricans (AN) with elements of metabolic syndrome Korelacja rang Spearmana Para zmiennych R p AN & poziom triglicerydów 0,20 <0,001 AN & poziom HDL-cholesterolu -0,15 < 0,01 AN & glikemia na czczo 0,07 NS AN & obwód pasa 0,21 < 0,001 AN & RR skurczowe 0,23 < 0,001 AN & RR rozkurczowe 0,17 < 0,001 Dyskusja Częstość występowania otyłości u dzieci, przybierająca w niektórych krajach rozmiary epidemii, oraz znane powikłania zdrowotne otyłości stwarzają pilną potrzebę opracowania prostych testów prze- siewowych, pozwalających wyodrębnić grupę dzieci otyłych szczególnie zagrożonych rozwojem powikłań naczyniowych i metabolicznych. W ostatnich latach szczególne zainteresowanie naukowców jak i lekarzy praktyków dotyczy obecności zespołu metabolicznego (ZM) u dzieci i młodzieży, ze53 Praca oryginalna społu rozumianego jako współistnienie określonych zaburzeń, w istotny sposób zwiększających ryzyko wystąpienia chorób układu sercowo-naczyniowego i cukrzycy typu 2. Ponadto, jak wykazali Vanhala i wsp. [17], otyłość w dzieciństwie predysponuje do rozwoju zespołu metabolicznego w życiu dorosłym. W pracy postanowiono sprawdzić, czy rogowacenie ciemne, stosunkowo często spotykane u dzieci otyłych, może być łatwo rozpoznawalnym objawem klinicznym sugerującym obecność zespołu metabolicznego. Spośród 578 badanych rogowacenie ciemne rozpoznano u 164 (28,4%) dzieci. U większości z nich (92,7%) rozpoznano również zespół metaboliczny. Zatem częstość zespołu metabolicznego w badanej przez nas grupie dzieci i młodzieży z otyłością wynosiła ponad 26 procent. Wyniki badań dotyczących częstości występowania zespołu metabolicznego w populacji dziecięcej są często rozbieżne, gdyż jak dotąd nie opracowano jednolitej definicji zespołu dla dzieci i młodzieży. W badaniach NHANES III, przeprowadzonych w Stanach Zjednoczonych w latach 1988–1994, częstość ZM u nastolatków z prawidłową masą ciała lub nadwagą oceniono na 4,2%, a u otyłych (BMI > 95 centyla) – na 28,7% [18]. Niektórzy autorzy uważają jednak, że dane te mogą być obecnie uważane za zaniżone, z uwagi na znaczny wzrost otyłości, jaki nastąpił w ostatniej dekadzie [19]. Weiss i wsp. [19] rozpoznali zespół metaboliczny u 39% badanych (w wieku od 4 do 20 lat) z umiarkowaną otyłością i aż u 50% dzieci z otyłością olbrzymią. W populacji europejskiej częstość zespołu metabolicznego jest nieco niższa. Csabi i wsp. [20] stwierdzili ZM u 9% otyłych dzieci węgierskich. Na rozbieżność uzyskanych wyników niewątpliwy wpływ miało przyjęcie przez autorów różnych kryteriów rozpoznania zespołu. W badaniach własnych przyjęto kryteria zaproponowane przez Ferranti i wsp. [12], którzy Endokrynol. Ped., 5/2006;2(15):49-55 zmodyfikowali definicję ZM podaną przez NCEP – ATP III [5]. Z uwagi na brak ogólnopolskich siatek centylowych obwodu pasa u dzieci, który jest ważnym parametrem pozwalającym w przybliżeniu oszacować stopień otyłości brzusznej i zagrożenie wystąpieniem ZM [21], w badaniach własnych przyjęto normy obwodu pasa, opracowane na podstawie pomiarów antropometrycznych dzieci z prawidłową masą ciała. Wyniki badań własnych dotyczące częstości występowania poszczególnych parametrów ZM u dzieci otyłych są zbliżone do uzyskanych przez innych autorów [12, 19, 20]. Spośród nieprawidłowości składających się na zespół metaboliczny u dzieci najczęściej stwierdza się dyslipidemię i otyłość brzuszną. Rzadziej rozpoznawane jest nadciśnienie tętnicze, a wyjątkowo hiperglikemia. Obecność zmian skórnych o typie rogowacenia ciemnego koreluje w sposób znamienny z parametrami zespołu metabolicznego. W badaniach własnych najsilniejszą korelację wykazywały obwód pasa, stężenie triglicerydów i wielkość ciśnienia tętniczego. Potwierdza to przydatność rogowacenia ciemnego jako łatwo rozpoznawalnego markera zespołu metabolicznego. W dostępnym piśmiennictwie nie znaleziono badań łączących obecność rogowacenia ciemnego z zaburzeniami składającymi się na zespół metaboliczny, rozpoznawany według kryteriów ATP III, aczkolwiek w wielu badaniach wykazano związek między wskaźnikami insulinooporności i acanthosis nigricans [22, 23]. Wnioski Stwierdzenie rogowacenia ciemnego u dziecka z otyłością wskazuje na konieczność przeprowadzenia szczegółowych badań w kierunku obecności zespołu metabolicznego. PIŚMIENNICTWO/REFERENCES [1] [2] [3] [4] [5] [6] 54 Kinalska I. (red.): Patofizjologia i następstwa kliniczne insulinooporności. Polskie Towarzystwo Kardiodiabetologiczne, Białystok 2005. Reaven G.M.: banting lecture 1988. Role of insulin resistance in human disease. Diabetes, 1988:37, 1595–1607. The IDF consensus worldwide definition of the metabolic syndrome. Bruksela 2005, 1–7. Definition, diagnosis and classification of diabetes mellitus and its complications. Report of WHO consultations. WHO, Genewa 1999. Executive summary of the third report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). JAMA, 2001:285, 2486–2497. Broda G., Szcześniewska D., Rywik S.: Częstość występowania zespołu metabolicznego w populacji osób dorosłych Warszawy. Med. Metabol., 2003:2, 25–29. Garanty-Bogacka B. i inni – Czy acanthosis nigricans może być markerem zespołu metabolicznego u dzieci z otyłością prostą? [7] [8] [9] [10] [11] [12] [13] [14] [15] [16] [17] [18] [19] [20] [21] [22] [23] Hanson R.L., Imperatore G., Bennett P.H. et al.: Components of the „metabolic syndrome“ and incidence of type 2 diabetes. Diabetes, 2002:51, 3120–3127. Lakka H.M., Laaksonen D.E., Lakka T.A. et al.: The metabolic syndrome and total and cardiovascular disease mortality in middle-aged men. JAMA, 2002:288, 2709–2716. Goran M.I., Gower B.A.: Abdominal obesity and cardiovascular risk in children. Coron. Artery Dis., 1998:9, 483–487. Arslanian S.: Type 2 diabetes in children: clinical aspects and risk factors. Horm. Res., 2002:57, Suppl. 1, 19–28. Steinberger J., Daniels S.R.: Obesity, insulin resistance, diabetes, and cardiovascular risk in children: an American Heart Association scientific statement from the Atherosclerosis, Hypertension, and Obesity in the Young Committee (Council on Cardiovascular Disease in the Young) and the Diabetes Committee (Council on Nutrition, Physical Activity, and Metabolism). Circulation, 2003:107, 1448–1453. Ferranti S.D., Gauvreau K., Ludwig D.S. et al.: Prevalence of the metabolic syndrome in American adolescents. Findings from the Third National Health and Nutrition Examination Survey. Circulation, 2004:110, 2494–2497. Torley D., Bellus G.A., Munro C.S.: Genes, growth factors and acanthosis nigricans. Br. J. Dermatol., 2002:147, 1096– 1101. Stuart C.A., Driscoll M.S., Lundquist K.F. et al.: Acanthosis nigricans. J. Basic & Clin. Phisiol. & Pharmacol., 1998:9, 407– 418. Palczewska I., Niedźwiecka Z.: Wskaźniki rozwoju fizycznego dzieci i młodzieży warszawskiej. Med. Wieku Rozwojowego 2001: (suppl. 1). National High Blood Pressure Education Programme Working Group on Hypertension Control in Children and Adolescents. Update on the 1987 Task Force Report on High Blood Pressure in Children and Adolescents: a working group report from the National High Blood Pressure Education Programme. Pediatrics, 1996:98, 649–658. Vanhala M.J., Vanhala P.T., Keinanen-Kiukaanniemi S.M. et al.: Relative weight gain and obesity as a child predict metabolic syndrome as in adults. Int. J. Obes. Relat. Metab. Disord., 1999:23, 656–659. Cook S., Weitzman M., Auinger P. et al.: Prevalence of a metabolic syndrome phenotype in adolescents. Arch. Pediatr. Adolesc. Med., 2003:157, 821–827. Weiss R., Dziura J., Burgert T.S. et al.: Obesity and the metabolic syndrome in children and adolescents. N. Engl. J. Med., 2004:350, 2362–2374. Csabi G., Torok K., Jeges S. et al.: Presence of metabolic cardiovascular syndrome in obese children. Eur. J. Pediatr., 2000: 159, 91–94. Moreno L.A., Pineda I., Rodriguez G. et al.: Waist circumference for the screening of the metabolic syndrome in children. Acta Paediatr., 2002:91, 1307–1312. Hermanns-Lee T., Hermanns J.F., Pierard G.E.: Juvenile acanthosis nigricans and insulin resistance. Pediatr. Dermatol., 2002:19, 12–14. Nguyen T.T., Keil M.F., Russell D.L. et al.: Relation of acanthosis nigricans to hyperinsulinemia and insulin sensitivity in overweight African American and white children. J. Pediatr., 2001:138, 474–480. 55