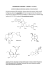7 listopada 2010 roku I ROK BIOTECHNOLOGII (STUDIA
Transkrypt
7 listopada 2010 roku I ROK BIOTECHNOLOGII (STUDIA
7 listopada 2010 roku I ROK BIOTECHNOLOGII (STUDIA WIECZOROWE) zadania na 10 listopada 2010 roku – odpowiedzi 1. Podkreśl związki aromatyczne. Dlaczego pozostałe nie są aromatyczne? b) a) H C h) H C i) d) c) e) k) l) O S H N O j) g) f) N H N m) N N n) N Cząsteczki związków a), b) i j) nie spełniają reguły Hückla. 2. Narysuj wzory: o-dinitrobenzenu, p-nitrostyrenu, 2,4,6-tribromoaniliny, m-aminobenzaldehydu, o-ksylenu, p-chloronitrobenzenu, alkoholu p-jodobenzylowego, kwasu 2,4-dibromobenzoesowego. NH2 NO2 Br CHO Br O2N NO2 NH2 Br CH3 COOH OH Cl O2N I CH3 Br Br 3. Nazwij związki: COOH OH CH3 OCH3 Cl Cl Cl m-chlorotoluen OCH3 Cl 2,4-dichlorofenol o-chloanizol SO3H OCH3 kwas p-metoksybenzoesowy Cl Br NO2 kwas m-nitrobenzenosulfonowy OH 2-fenyloetan-1-ol OCH3 m-dimetoksybenzen Cl 2-bromo-1,3-dichlorobenzen 4. Zapisz równania reakcji postawania elektrofila w reakcjach: a. fluorowcowania X2 + AlX3 → X+ + AlX4– lub X2 + FeX3 → X–X+···FeX3 (X = Cl, Br) b. nitrowania HNO3 + 2H2SO4 → NO2+ + H3O+ + 2HSO4– c. sulfonowania SO3 + H2SO4 → HSO3+ + HSO4– d. alkilowania (2 sposoby) np.: H3C–CH2–Cl + AlCl3 → H3C–CH2+ + AlCl4– lub H2C=CH2 + H3O+ → H2C–CH2+ + H2O e. acylowania O O + AlCl3 np.: + AlCl4- Cl 5. Zapisz pełną reakcję bromowania ANIZOLU, czyli: a) zapisz reakcję tworzenia elektrofila b) zapisz wszystkie struktury rezonansowe stanu przejściowego (w tym przypadku są CZTERY). Pamiętaj, aby skierować podstawnik w dobrą pozycję. c) wskaż która ze struktur jest NAJTRWALSZA (i tym samym odpowiada za efekt kierowania podstawnika w odpowiedni(ą)e pozycj(ę)e) d) narysuj wzór i nazwij prawidłowo produkt (produkty) e) wskaż, który powinien się tworzyć w większej ilości (jeśli jest więcej niż jeden) Br2 + AlBr3 → Br+ + AlBr4– Reakcja powstawania elektrofila: OCH3 Br+ OCH3 H anizol Br ↔ H Br ↔ OCH3 OCH3 Br o-bromoanizol p-bromoanizol + Br OCH3 OCH3 H Br ↔ AlBr4– H Br –HBr –AlBr3 6. Zaznacz, które podstawniki są aktywujące, a które dezaktywujące, oraz które kierują w pozycje orto/para, a które w pozycję meta: –NH2 –OH –OCH3 –NHCOCH3 –CH3 } AKTYWUJĄCE –Cl –COCH3 –COOH –COOCH3 DEZAKTYWUJĄCE –CONH2 } orto / para } meta –SO3H –CN –NO2 7. Pamiętając o wpływie kierującym podstawników, jak otrzymać p-etylonitrobenzen z benzenu? Narysuj substrat, produkt pośredni i produkt. Nazwij produkt pośredni. Czy powstanie wyłącznie jeden produkt? C2H5Cl HNO3 AlCl3 H2SO4 etylobenzen benzen O 2N p-etylonitrobenzen 8. Masz do wyboru: alkilowanie, acylowanie, halogenowanie (chlorowanie, bromowanie), nitrowanie, sulfonowanie. Otrzymaj: a. m-bromoacetofenon z benzenu (w dwóch krokach) O H3C Cl AlCl3 O O CH3 Br2, AlBr3 CH3 Br b. p-bromoacetofenon z benzenu (w dwóch krokach) O Br2, AlBr3 Br H3C Cl AlCl3 O Br CH3 c. m-chloronitrobenzen z benzenu (w dwóch krokach) Cl HNO3, H2SO4 NO2 Cl2, AlCl3 NO2 Wypisz wzory wszystkich związków pośrednich i wszystkie reagenty. Dodatkowe informacje n.t. substytucji elektrofilowej w pierścieniu benzenowym: 1. Pamiętaj, że nie można bezpośrednio (w łatwy sposób) wprowadzić grup OH, COOH i NH2 do pierścienia. 2. Grupy –OH, –NH2, –NHR muszą być nieobecne lub zabezpieczone w czasie utleniania grupy alkilowej do karboksylowej 3. Związki, zawierające grupy –OH, –NH2, –NHR, nie mogą być nitrowane mieszaniną nitrującą, bowiem grupy te uległyby utlenieniu. UWAGA: Grupy –NH2, –NHR i –NR2 w silnie kwaśnym środowisku mieszaniny nitrującej ulegają proponowaniu, tworząc –NH3+, –NH2R+ i –NHR2+ (które kierują w położenie meta !!!) UWAGA 2: Z tych przyczyn grupy –NH2 oraz –NHR zabezpiecza się bezwodnikiem octowym do grup –NHCOCH3 lub –NRCOCH3, które: - nie ulegają utlenieniu ani proponowaniu pod wpływem mieszaniny nitrującej - kierują wyłącznie w położenie para (są to duże grupy) - następuje mononitrowanie 4. Związki zawierające podstawniki, kierujące w pozycję meta są niereaktywne w reakcjach alkilowania oraz arylowania Friedela-Craftsa; aminy również źle reagują. 9. Zapisz produkt lub substrat reakcji, albo reagent: KMnO4, H2O, 100°C COOH Br Br2, hν FeBr3 Br2, ............ Br + Br Dr Bartosz Trzewik