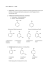Instrukcja do ćwiczenia nr 2 - 6.03.2015
Transkrypt
Instrukcja do ćwiczenia nr 2 - 6.03.2015
Instrukcja do ćwiczenia nr 2 ‐ 6.03.2015 Toksykologia wybranych związków organicznych Rozpuszczalnikami organicznymi nazywamy lotne, w warunkach normalnych, ciecze, które rozpuszczają substancje organiczne, szczególnie te, które nie rozpuszczają się w wodzie. Są one zróżnicowane pod względem chemicznym, a najważniejsze z nich to: węglowodory i ich chlorowcowe pochodne, ketony, alkohole, estry, etery i disiarczek węgla. Rozpuszczalniki organiczne stosuje się przede wszystkim w przemyśle do rozpuszczania i rozcieńczania substratów i produktów. Znajdują również zastosowanie jako środki chłodzące w urządzeniach zamrażających, do gaszenia pożarów, do dezynfekcji, jako materiały pędne itp. Drogami wnikania rozpuszczalników do organizmu są przewód pokarmowy, układ oddechowy i skóra. Niektóre z rozpuszczalników ułatwiają wchłanianie innych związków do ustroju. Rozpuszczalniki działają drażniąco na skórę, a po wchłonięciu w większych stężeniach do krążenia wywierają działanie narkotyczne. Do grupy rozpuszczalników aromatycznych należy benzen - najprostszy węglowodór aromatyczny. Benzen powoduje uszkodzenie układu nerwowego i szpiku kostnego (u osób narażonych na częsty kontakt z benzenem może to być przyczyną białaczki). Homologami benzenu są toluen, etylobenzen i ksyleny. Substancje te to lotne, palne ciecze o charakterystycznym zapachu, nie mieszające się z wodą. Stosowane są jako rozpuszczalniki lakierów, farb drukarskich, klejów i gumy, jako środki ekstrahujące, odtłuszczające oraz czyszczące. Są ważnymi surowcami w przemyśle chemicznym i farmaceutycznym. Objawami ostrego zatrucia rozpuszczalnikami aromatycznymi może być podrażnienie błon śluzowych układu oddechowego, bóle i zawroty głowy, pobudzenie, nudności, wymioty. W dużych stężeniach związki te działają narkotycznie, uszkadzają wątrobę i nerki, powodują zaburzenia rytmu serca z ryzykiem migotania komór, utraty przytomności i śmierci. Ciekłe ksyleny mają miejscowe działanie drażniące, wywołują podrażnienie spojówek i ich zaczerwienienie; mogą spowodować uszkodzenie rogówki. Omówione powyżej rozpuszczalniki organiczne należą do substancji łatwopalnych, natomiast do rozpuszczalników niepalnych należą chlorowcowe pochodne węglowodorów alifatycznych, jak chloroform, di- i tetrachlorometan. Efekt toksyczny tej grupy rozpuszczalników wiąże się z odszczepianiem chloru przy udziale enzymów mikrosomalnych i wytwarzaniem wolnych rodników, a końcowym produktem tych przemian jest tlenek węgła. Większość z tej grupy rozpuszczalników prawdopodobnie wykazuje własności kancerogenne. Wiadomo, że chlorowcopochodne mają działanie hepatotoksyczne, które wzrasta ze wzrostem liczby atomów chloru w cząsteczce. Z kolei disiarczek węgla niezwykle łatwo ulega samozapłonowi. Temperatura jego samozapłonu jest niższa niż 100°C, z możliwością wybuchu par. Disiarczek węgla w największych ilościach jest stosowany jako rozpuszczalnik do wytwarzania włókien wiskozowych. Jest też stosowany w syntezie organicznej i jako rozpuszczalnik do flotacji minerałów. Należy do związków trujących o działaniu szkodliwym na ośrodkowy układ nerwowy. Długotrwałe wchłanianie disiarczku węgla w niższych stężeniach powoduje trwałe uszkodzenia mózgu. Związek ten wykazuje też działanie rakotwórcze i mutagenne. 1.a.Badanie właściwości fizycznych rozpuszczalników organicznych: acetonu, metanolu, etanolu, izopropanolu, butanolu, eteru, chloroformu, heksanu, toluenu, ksylenu, octanu etylu, disiarczku węgla – ocena zapachu i rozpuszczalności w wodzie. Badanie zapachu - należy zbliżyć wylot probówki, w której znajduje się badany rozpuszczalnik do nosa i wykonać szybki, delikatny wdech przez nos z jednoczesną wentylacją dłonią. badanego rozpuszczalnika Badanie rozpuszczalności w wodzie dodać 1 cm3 do probówki napełnionej w 1/3 wodą destylowaną, od czasu do czasu wstrząsając. Po upływie kilku minut ocenić stopień rozpuszczenia badanego rozpuszczalnika w wodzie. Toksyczność wybranych alkoholi Do najczęściej stosowanych rozpuszczalników należą alkohole, a wśród nich etanol, jeden z najbardziej popularnych środków uzależniających i psychoaktywnych. Oddziałuje on na błonę śluzową jamy ustnej, przełyku, żołądka i górnej części jelita cienkiego. Nadużywanie alkoholu jest przyczyną zaburzeń w układach: nerwowym, dokrewnym, krążenia, pokarmowym, moczowo-płciowym i mięśniowym. U osób nadużywających alkoholu, częściej niż u nie pijących, stwierdza się nowotwory złośliwe różnych narządów. Podobnie jak alkohol etylowy, alkohol metylowy równie dobrze wchłania się przez drogi oddechowe oraz przez skórę (główna przyczyna zatruć w przemyśle), a także przez przewód pokarmowy. Jest bardzo silną trucizną, nieporównywalnie silniejszą od alkoholu etylowego. Tę dużą toksyczność potęguje fakt, że metanol kumuluje się w ustroju, osiągając w tkankach znacznie wyższe stężenie, a jego eliminacja z krwi przebiega czterokrotnie wolniej niż etanolu. W pierwszym etapie metabolizmu metanol ulega przemianie do aldehydu mrówkowego pod wpływem dehydrogenazy alkoholowej, następnie przechodzi w kwas mrówkowy, który dalej zostaje utleniony do CO2 i H2O. Aldehyd i kwas mrówkowy są odpowiedzialne za uszkadzanie nerwu wzrokowego, co często prowadzi do ślepoty. Wystąpienie objawów zatrucia metanolem może mieć miejsce nawet w dobę po jego spożyciu. Pierwsze objawy to bóle głowy, nudności, wymioty, osłabienie. W dalszym przebiegu zatrucia pojawiają się zaburzenia widzenia, potem sinica, śpiączka, zapaść i śmierć. Charakterystyczne są zaburzenia gospodarki kwasowo-zasadowej pod postacią kwasicy metabolicznej. W takich przypadkach bardzo ważne jest zapewnienie zatrutemu jak najszybciej specjalistycznej opieki medycznej. 1.b.Wykrywanie etanolu w ślinie Alkohol można też wykrywać czułymi i łatwymi do zastosowania testami. Takim testem może być ALCOSCREEN firmy Chematics. Jest to nieinwazyjny test umożliwiający wykrywanie alkoholu w ślinie. Test działa w taki sposób, że w wyniku kontaktu z alkoholem zawartym w ślinie (proporcjonalnie do stężenia alkoholu w krwi) zachodzi reakcja z chromo-gennym składnikiem testu. Pojawia się zabarwienie od jasnozielono-szarego do ciemnoniebiesko-szarego w zależności od stężenia alkoholu w krwi (do 3 ‰). Jeśli wymagane jest dokładne określenie stężenia alkoholu, pozytywny wynik uzyskany za pomocą ALCO-SCREEN musi być zweryfikowany za pomocą odpowiedniej procedury umożliwiającej dokładny pomiar. Wykonanie ćwiczenia: Nanieść próbkę śliny na obszar testowy i odczekać 2 minuty. Próbnik testu (miejsce gdzie umieszcza się próbkę śliny) powinien mieć kolor jasnokremowy. Oszacować stężenie alkoholu w krwi, porównując kolor próbnika z kolorami na opakowaniu testu. Wykrywanie etanolu w wydychanym powietrzu? 1.c. Wykrywanie metanolu – próba kroplowa Wykonanie ćwiczenia: We wgłębieniu płytki porcelanowej umieścić kryształek fosforanu kodeiny, a następnie zwilżyć 1 kroplą stężonego kwasu siarkowego (96%). Do probówki odmierzyć 3 krople roztworu metanolu (50%, v/v), a następnie 15 kropel stężonego kwasu siarkowego. Probówkę ochłodzić w łaźni z zimną wodą. Odmierzyć 3 krople tak sporządzonej mieszaniny do wgłębienia, gdzie znajdowała się kodeina. Powstająca po czasie barwa niebieska wskazuje na obecność metanolu. Toksyczność glikolu etylenowego Glikol etylenowy jest bezbarwną, oleistą cieczą, o słodkawym smaku, mieszającą się dobrze w każdym stosunku z wodą. Znajduje on zastosowanie jako rozpuszczalnik celulozy i niektórych farb. Może wchodzić w skład preparatów przeciw zamarzaniu szyb, płynów do chłodnic, tuszów do stempli oraz żywic syntetycznych. Glikol etylenowy najczęściej dostaje się do ustroju po omyłkowym lub celowym wypiciu płynu zawierającego w składzie glikol, np. płynu do chłodnic. Przemiany metaboliczne (głównie utlenianie) prowadzą do powstania kwasu szczawiowego, odpowiedzialnego za występujące w ostrych zatruciach zmiany w nerkach i występującą zawsze bardzo głęboką kwasicę metaboliczną. Część glikolu wydalana jest z moczem w formie niezmienionej. Z powietrzem wydychanym wydalany jest w postaci dwutlenku węgla w ilości 60% w ciągu 3 dni, a mniej niż 2% wydalane jest w postaci kwasu szczawiowego. Wydalanie tego metabolitu przebiega bardzo wolno i trwa od 2 do 6 tygodni. Za działanie toksyczne odpowiedzialny jest również kwas glioksalowy i glikolowy oraz inne kwasy organiczne (rys. poniżej). CH2NH2 CH2NHCOC6H5 CH2OH CH2OH kwas aminooctowy (glicyna) CH2OH CH2OH CH2OH CHO CH2OH CHO COOH COOH glikol etylenowy aldehyd glikolowy kwas glikolowy kwas hipurowy HCOOH kwas mrówkowy kwas glioksalowy CO2 COOH + H2O COOH kwas szczawiowy Glikol etylenowy wywiera działanie narkotyczne, a gromadząc się w płynie mózgowo-rdzeniowym, może wywołać ciężkie uszkodzenie ośrodkowego układu nerwowego. Ma również dużą zdolność penetrowania innych tkanek i narządów. W ostrym zatruciu glikolem można wyróżnić trzy okresy. Pierwszy rozpoczyna się w 30 minut do 12 godzin od spożycia i charakteryzuje się objawami narkotycznymi ze strony OUN, podobnymi do zatrucia alkoholem etylowym oraz stopniowo rozwijającą się kwasicą. W drugim okresie pojawia się niewydolność układu krążenia i oddychania, jak również objawy obrzęku mózgu i napady padaczkowe. Powstają zmiany zwyrodnieniowe w siatkówce oka i nerwie wzrokowym. W trzecim okresie nasilają się objawy niewydolności nerek i narasta kwasica. 1.d. Wykrywanie glikolu etylenowego Wykonanie ćwiczenia: Do ok. 1 cm3 glikolu etylenowego dodać 1 cm3 roztworu wodorotlenku i kroplami roztwór siarczanu miedzi (10%). Powstający wodorotlenek miedzi z glikolem związek rozpuszczalny w wodzie o zabarwieniu niebieskim. Na2SO4 + Cu(OH)2 2 NaOH + CuSO4 H H C H C H sodu (10%) (II) tworzy H H + Cu(OH)2 OH OH H C C H + 2H2O O O Cu Toksyczność formaldehydu Formaldehyd – aldehyd mrówkowy, HCHO, jest gazem bezbarwnym, o ostrej przenikliwej woni. Roztwór wodny zawierający 40% formaldehydu nazywany jest formaliną. Formaldehyd denaturuje białko, powodując martwicę tkanek. Roztwór formaliny 4-10% wywołuje wyraźne zmiany w błonach śluzowych. Wprowadzony do krwi przeciwdziała jej krzepnięciu, przy czym duże ilości powodują, że krzepnienie krwi zostaje zupełnie zahamowane. W stężonych roztworach formaldehyd działa żrąco. 1.e. Wykrywanie formaldehydu (aldehydu mrówkowego) Powstający z soli srebrowych w zasadowym środowisku osad Ag2O w obecności nadmiaru amoniaku przechodzi do roztworu w postaci związku kompleksowego – wodorotlenku diaminasrebra(I). Związek ten pod wpływem aldehydów łatwo redukuje się do wolnego srebra, wydzielającego się jako ciemny osad, lub na odpowiednio oczyszczonych ściankach probówki w postaci lustra. Aldehyd mrówkowy ulega utlenieniu do kwasu mrówkowego. Ag2O + 4NH3 + H2O 2[Ag(NH3)2]OH + R 2[Ag(NH3)2]OH O O R C C OH H + 2Ag + 4NH3 + H2O Wykonanie ćwiczenia Do 1 cm3 roztworu formaldehydu wprowadza się 1 cm3 amoniakalnego roztworu tlenku srebra i zawartość lekko ogrzewa. Wydziela się ciemny osad metalicznego srebra (przed przystąpieniem do reakcji probówkę przemyć wrzącym ługiem i przepłukać wodą destylowaną). Dodanie 2–3 kropli roztworu ługu przyspiesza proces redukcji. Toksyczność fenolu Fenol należy do substancji toksycznych i palnych. Pary fenolu tworzą z powietrzem mieszaniny wybuchowe i działają drażniąco na oczy. Fenol jest bardzo dobrze wchłaniany zarówno drogą pokarmową, drogą oddechową jak i poprzez skórę. Powoduje oparzenia. Ponadto fenol uszkadza wątrobę i nerki, działa neurotoksycznie powodując demielinizację włókien nerwowych i jako jeden z metabolitów benzenu jest odpowiedzialny za uszkodzenie szpiku kostnego. Fenol działa również szkodliwie na organizmy lądowe i wodne. 1.f. Wykrywanie fenolu i jego rozpuszczalność w wodzie Wykrywanie fenolu - reakcja fenolu z chlorkiem żelaza(III) Wykonanie ćwiczenia Do roztworu fenolu dodać kroplę rozcieńczonego roztworu FeCl3. Występuje fiołkowe zabarwienie, które znika po zakwaszeniu silnym kwasem. Reakcja ta, w wyniku której powstają produkty o różnym zabarwieniu, jest charakterystyczna dla wszystkich fenoli i ich pochodnych z wolną grupą hydroksylową. C6H5OH + FeCl3 [C6H5OFe]2+ + 2Cl- + HCl Rozpuszczalność fenolu w wodzie Wykonanie ćwiczenia Szczyptę fenolu zalać w probówce 1 cm3 wody. Fenol rozpuszcza się powoli, tworząc dwie warstwy: górna to roztwór fenolu w wodzie, dolna zaś roztwór wody w fenolu. Odczyn tych roztworów jest wyraźnie kwaśny, niebieski papierek lakmusowy czerwienieje. Jeśli do roztworu fenolu w wodzie dodać kilka kropel wodorotlenku sodu lub potasu, fenol rozpuści się zupełnie, tworząc odpowiedni fenolan dobrze rozpuszczalny w wodzie. 1.g. Wykrywanie amin I-rzędowych Aminy I-rzędowe reagują z HNO2, dając wolny azot, alkohol i wodę. R―NH2 + NaNO2 + HCl N2↑ + R―OH + H2O + NaCl Wykonanie ćwiczenia Do roztworu chlorowodorku metyloaminy dodać 0,5 cm3 0,1-molowego kwasu solnego i parę kropli azotanu(III) sodu. Wydzielają się pęcherzyki azotu i tworzy się metanol.