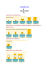Przemiany kataboliczne aminokwasów
Transkrypt
Przemiany kataboliczne aminokwasów
Metabolizm białek Ogólny schemat metabolizmu bialek Trawienie białek i absorpcja aminokwasów w przewodzie pokarmowym w żołądku –(niskie pH ~2, rola HCl)- hydratacja, homogenizacja, denaturacja białek i wstępna degradacja do mniejszych peptydów przez pepsynę w świetle jelita cienkiego (pH ~7-8), intensywna degradacja oligopeptydów do krótkich peptydów i aminokwasów przez endopeptydazy (rozkład wiązania peptydowego wewnątrz łańcucha polipeptydowego przez enzymy trzustkowe: trypsynę, chymotrypsynę) i egzopeptydazy (rozkład wiązań peptydowych z jednego lub drugiego końca łańcucha polipeptydowego przez karboksypeptydazy, aminopeptydazy, dipeptydazy) wchłanianie aminokwasów przez komórki nabłonka jelita cienkiego (kotransport z jonami Na+) i transport żyłą wrotną do wątroby i dalej do krążenia ustrojowego. Bilans azotowy Organizm człowieka nie magazynuje azotu, który jest niezbędny do syntezy białek i innych, ważnych związków azotowych o znaczeniu fizjologicznym. Bilans azotowy to różnica pomiędzy dzienną ilością azotu przyjętego wraz z dietą, głównie wraz z białkami (Nabs) a ilością azotu wydalonego z moczem (Nwyd), głównie z formie mocznika, jonów amonowych, kreatyniny i kwasu moczowego. U zdrowych osób dorosłych: (Nabs-Nwyd)=0 (równowaga azotowa) U dzieci, młodzieży w okresie wzrostu, ciąży, budowy masy mięśniowej: (Nabs-Nwyd)>0 (dodatni bilans azotowy) U osób niedożywionych, w diecie ubogo-białkowej, w wyniszczających chorobach: (Nabs-Nwyd) <0 (ujemny bilans azotowy) Aminokwasy egzogenne (niezbędne) i endogenne endogenne egzogenne Alanina Arginina* Asparagina Histydyna Asparaginian Izoleucyna Cysteina Leucyna Glutaminian Lizyna Glutamina Metionina Glicyna Fenyloalanina* Prolina Treonina Seryna Tryptofan Tyrozyna Walina Aminokwasy glikogenne i ketogenne Aminokwasy glikogenne –to aminokwasy, które mogą być wykorzystane w wątrobie do syntezy glukozy. Aminokwasy ketogenne to aminokwasy, które mogą być użyte do tworzenia ciał ketonowych (kwas -hydroksymasłowy, acetooctan, aceton). Aminokwasy glikogenne i ketogenne Glikogenne Alanina Arginina Kwas asparaginowy Asparagina Cysteina Kwas glutaminowy Glutamina Glicyna Histydyna Prolina Hydroksyprolina Metionina Seryna Treonina Walina (Sciśle) Ketogenne Leucyna Lizyna Glikogenne i ketogenne Izoleucyna Fenyloalanina Tryptofan Tyrozyna Przemiany aminokwasów Transaminacja: Transaminacja jest reakcją odwracalnej przemiany polegającej na przeniesieniu grupy aminowej (-NH2) z aminokwasu (donor grupy -NH2) na ketokwas (akceptor grupy -NH2), w wyniku której aminokwas przekształca się w swój ketoanalog (ketokwas), a akceptor grupy -NH2 – w odpowiedni aminokwas. Reakcja jest katalizowana przez transaminazy (enzymy należące do klasy transferaz), których koenzymem jest fosforan pirydoksalu (PLP). Mechanizm reakcji transaminacji: Grupa aminowa (-NH2) aminokwasu biorącego udział w tej reakcji reaguje z PLP tworząc tzw. zasadę Schiffa, co w wyniku kolejnych przemian prowadzi do powstania pirydoksaloaminy (PMP) oraz pochodnej ketonowej aminokwasu (α-ketokwasu , czyli ketoanalogu aminokwasu). PLP-pochodna witaminy B6 PMP-pirydoksaloamina Pirydoksaloamina (PMP) może reagować z ketokwasem (α-ketoglutaranem, szczawiooctanem, lub pirogronianem), w wyniku czego tworzą się, odpowiednio, glutaminian, asparaginian lub alanina. Głównym akceptorem grup aminowych jest α-ketoglutaran, ponieważ glutaminian będący produktem tej reakcji może być poddany dezaminacji oksydacyjnej umożliwiającej definitywne oderwanie grupy aminowej w formie amoniaku (NH3). Szkielety węglowe ketokwasów uzyskane w wyniku transaminacji mogą włączać się do przemian katabolicznych w celu produkcji energii lub służyć jako substraty do syntezy glukozy lub kwasów tłuszczowych. Dezaminacja oksydacyjna glutaminianu Utlenienie glutaminianu przez dehydrogenazę glutaminianową jest główną reakcją umożliwiającą usunięcie N z ustrojowej puli aminokwasów w formie amoniaku (NH4+). Akceptorami wodorów w tej reakcji utlenienia są NAD+ lub NADP+ . Poniżej pokazano schemat przedstawiający rolę transaminaz w kierowaniu N aminowego na glutaminian. W wyniku deaminacji oksydacyjnej katalizowanej przed dehydrogenazę glutaminianową powstaje α-ketoglutaran oraz NH4+. Cykl mocznikowy przebiega w wątrobie, a w wyniku tej reakcji silnie toksyczny amoniak zostaje przekształcony do mniej toksycznego mocznika. Pierwszy etap reakcji to synteza karbamoilo-fosforanu z NH3 i HCO3 katalizowana przez syntazę karbamoilo fosforanu kosztem energii uwolnionej z rozkładu 2 cząsteczek ATP. Reakcja ta, zlokalizowana w mitochondriach, jest nieodwracalna.. Dalszy przebieg reakcji ma charakter cykliczny, początkowo przebiega w mitochondrium (do powstania cytruliny), a następnie w cytoplazmie (gdzie powstaje mocznik). Enzymy w mitochondrium :1. Karbamoilo transferaza ornitynowa Pozostałe 3 enzymy -w cytoplazmie: 2. syntetaza argininobursztynianowa 3. Liaza argininobursztynianowa 4. Arginaza Powrót ornityny do mitochondrium odbywa się przy udziale transportera białkowego w wewnętrznej błonie mitochondrialnej uczestniczącego w skoordynowanym przenoszeniu cytruliny do cytoplazmy, a ornityny do macierzy mitochondrialnej. Fumaran (powstały z rozpadu arginino-bursztynianu) jest przekształcany do szczawiooctanu przez enzymy cyklu Krebsa (fumarazę i dehydrogenazę jabłczanową), Szczawiooctan jest przekształcony do asparaginianu na drodze transaminacji, co umożliwia ponowne włączenie się asparaginianu do reakcji cyklu mocznikowego i odzyskanie 3 cząsteczek ATP Dlatego bilans energetyczny cyklu mocznikowego (ilość energii zużyta na przeprowadzenie NH3 w mocznik) wynosi : -1 ATP Wrodzony brak któregoś z enzymów cyklu mocznikowego prowadzi do hiperamonemii (podwyższony poziom amoniaku we krwi), co może doprowadzić do śmierci lub znacznego upośledzenia umysłowego. Przypuszczalny mechanizm neurotoksycznego działania podwyższonych stężeń amoniaku : Wysoki poziom amoniaku aktywuje reakcję katalizowaną przez syntazę glutaminową: glutamate + ATP + NH3 glutamine + ADP + Pi w wyniku czego spada stężenie kwasu glutaminowego, który jest ważnym neuroprzekaźnikiem i prekursorem syntezy innego neuroprzekaźnika ( kwasu gamma amino masłowego GABA) Spadek poziomu kwasu glutaminowego powoduje odwrócenie kierunku reakcji katalizowanej przez dehydrogenazę glutaminianu: glutamate + NAD(P)+ -ketoglutarate + NAD(P)H + NH4+ co oznacza spadek poziomu -ketoglutaranu, podstawowego metabolitu cyklu Krebsa, a w konsekwencji zaburzenie metabolizmu energetycznego w mózgu.