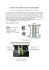Ogniwa paliwowe jako źródła energii elektrycznej i ciepła
Transkrypt
Ogniwa paliwowe jako źródła energii elektrycznej i ciepła
Ogniwa paliwowe jako źródła energii elektrycznej i ciepła (J. Paska) 1. Ogniwa galwaniczne, ogniwa paliwowe, akumulatory Ogniwa galwaniczne dzieli się na: 1. Ogniwa pierwszego rodzaju (pierwotne), w których następuje jednokierunkowe przetwarzanie energii chemicznej w elektryczną. Do grupy tej należą zarówno konwencjonalne (klasyczne) ogniwa galwaniczne, jak i ogniwa paliwowe. Konwencjonalne ogniwa galwaniczne charakteryzują się nagromadzeniem energii chemicznej w postaci substancji zdolnych do wchodzenia w reakcje elektrochemiczne. Po wyczerpaniu się jednego ze składników ogniwo takie przestaje działać. W ogniwach paliwowych uczestniczące w procesach elektrochemicznych substancje są dostarczane z zewnątrz, przy czym strumienie masy tych substancji są skorelowane z aktualnym obciążeniem ogniwa. Elektrody sterują jedynie procesami elektrochemicznymi, nie biorąc w nich bezpośredniego udziału. Żywotność ogniw paliwowych jest ograniczona jedynie trwałością elementów konstrukcyjnych, głównie elektrod. 2. Ogniwa drugiego rodzaju (wtórne), zwane akumulatorami. Są to konwencjonalne ogniwa galwaniczne, które można regenerować. W czasie rozładowywania następuje w nich przetwarzanie energii chemicznej w elektryczną, natomiast w czasie ładowania zachodzi przemiana odwrotna. Tablica 1. Charakterystyka termodynamiczna niektórych reakcji chemicznych (przy T = 298 K, p = 105 Pa) Sprawność termiczną idealnego procesu elektrochemicznego G określa wzór: ηt I I T S S 1 T t I I Substancja Wodór Metan Metanol Hydrazyna Tlenek węgla Węgiel Δg kJ/mol H2 + ½O2 → H2O + 2e1 -237,3 CH4 + 2O2 → CO2 + 2H2O + 8e -818,4 2CH3OH + 3O2 → 2CO2 + 4H2O + 6e -702,5 N2H4 + O2 → N2 + 2H2O + 4e -602,4 CO + 3/2O2 → CO2 + 2e -257,2 C + O2 → CO2 + 4e -394,6 Reakcja z tlenem Δi Δs ηt E kJ/mol kJ/(mol·K) V % -286 -0,1638 1,229 83,0 -980,8 -0,2666 1,06 91,9 -726,6 -0,0695 1,214 96,7 -622,4 -0,0126 1,56 96,8 -283,1 -0,0865 1,066 90,9 -393,7 +0,0029 1,02 100,02 Rys. 1. Przykłady konwencjonalnych ogniw galwanicznych: a) ogniwo Leclanchégo o budowie kubkowej, b) ogniwo indowo-rtęciowe o budowie guzikowej; 1 - elektroda ujemna, 2 - elektrolit, 3 - elektroda dodatnia, 4 - separator (izolacja), 5 - pierścień izolacyjny, 6 - zalewa, 7 - biegun dodatni, 8 - depolaryzator (braunsztyn MnO2), 9 - biegun ujemny Rys. 2. Zasada działania i reakcje w akumulatorze kwasowo-ołowiowym Podczas rozładowywania akumulatora zachodzą w nim następujące reakcje: na anodzie -Pb + SO4 → PbSO4 + 2e, na katodzie + -PbO2 + 4H + SO4 + 2e → PbSO4 + 2H2O. Regeneracja akumulatora następuje podczas jego ładowania, gdy zachodzą następujące reakcje: na anodzie + PbSO4 + 2H + 2e → Pb + H2SO4, na katodzie PbSO4 + 2OH → PbO2 + H2SO4 + 2e. 1 Elektron. 1 Ogniwa paliwowe jako źródła energii elektrycznej i ciepła (J. Paska) Tablica 2. Charakterystyka akumulatorów SEM Średnie napięcie robocze Energia właściwa Liczba ładowań Koszt jednostkowy V V W·h/kg USD/(kW h) Ołowiowy 2,14 2,0 35÷50 500 50÷100 Żelazowo-niklowy 1,34 1,2 24 2000 ? Niklowo-kadmowy 1,34 1,2 20÷50 1000÷2000 1000÷1200 Srebrowo-kadmowy 1,34 1,1 50 2000 ? Srebrowo-cynkowy (hermetyczny) 1,86 1,45 44÷100 100 ? Typ akumulatora 2. Budowa, zasada działania i rodzaje ogniw paliwowych Obciążenie a) b) Zużyty utleniacz i produkty gazowe Zużyte paliwo Prąd elektryczny Płyta końcowa Anoda Elektrolit Katoda H+ Rys. 3. Zasada działania (a) oraz budowa ogniwa paliwowego (b) Paliwo H2 O2 Przekładka Utleniacz H2O Anoda Elektrolit Paliwo Utleniacz Matrix Katoda Paliwo Płyta końcowa Elektroda paliwowa – anoda (-) a) Elektroda tlenowa – katoda (+) Elektrolit Utleniacz b) Rys. 4. Jedno z pierwszych ogniw paliwowych (a) oraz współczesne ogniwo paliwowe z elektrolitem polimerowym o mocy 1,2 kW (b) Rys. 5. Budowa porowatej elektrody gazodyfuzyjnej: A - obszar nieaktywny wypełniony elektrolitem, B - obszar aktywny obejmujący powierzchnię styku gazu z elektrolitem, C - obszar nieaktywny wypełniony gazem 2 Ogniwa paliwowe jako źródła energii elektrycznej i ciepła (J. Paska) Znane jest bardzo wiele typów ogniw paliwowych. Do najczęściej stosowanych należą: 1. Alkaliczne ogniwo paliwowe (Alkaline Fuel Cell – AFC) z wodnym roztworem wodorotlenku potasu KOH (35 50%) jako elektrolitem. Jest ono od dawna stosowane w kosmonautyce (NASA), wysokie koszty są przyczyną braku zastosowań komercyjnych. 2. Ogniwo paliwowe z kwasem fosforowym (Phosphoric Acid Fuel Cell – PAFC), ze stężonym kwasem fosforowym H3PO4 jako elektrolitem. Jest ono najpowszechniej używane w zastosowaniach komercyjnych, wadą są duże rozmiary i dość wysoka temperatura pracy. 3. Ogniwo paliwowe z elektrolitem polimerowym (Polymer Electrolyte Fuel Cell – PEFC), z polimerową membraną wymiany jonowej. Niska temperatura pracy oraz duża szybkość uzyskiwania mocy znamionowej są przyczynami coraz większego zainteresowania tym typem ogniwa. 4. Ogniwo paliwowe z elektrolitem ze stopionego węglanu (Molten Carbonate Fuel Cell – MCFC). Ogniwo to może być zasilane paliwami węglowodorowymi, ma wysoką sprawność i pracuje w wysokiej temperaturze, co umożliwia współpracę z turbiną parową. 5. Ogniwo paliwowe z elektrolitem ze stałych tlenków metali (Solid Oxide Fuel Cell – SOFC). Elektrolitem jest tutaj materiał ceramiczny, co pozwala na temperaturę pracy dochodzącą do 1000 C i rokuje perspektywy uzyskania dużych mocy. 6. Ogniwo paliwowe bezpośrednio zasilane metanolem (Direct Methanol/air Fuel Cell – DMFC). Jest to ogniwo z membraną polimerową, zasilane płynnym metanolem, z którego anoda pobiera wodór. 7. Ogniwo paliwowe zasilane cynkiem (Zinc Fuel Cell – ZnFC). Paliwem jest tutaj zgranulowany cynk, elektrolitem jest cyrkulujący KOH, a elektrody są zrealizowane jako cynkowa (anoda) i powietrzna (katoda). Tablica 3. Porównanie ogniw paliwowych różnych typów Ogniwa alkaliczne: elektrolit wodorotlenek potasu (AFC) Ogniwa z elektrolitem z kwasu fosforowego (PAFC) Ogniwa z elektrolitem polimerowym (PEFC) Ogniwa z elektrolitem ze stopionego węglanu (MCFC) Ogniwa z elektrolitem ze stałych tlenków (SOFC) Roztwór wodorotlenku potasu KOH Stężony kwas fosforowy H3PO4 Membrana polimerowa Mieszanina węglanów alkaicznych (Li, K, Na) Nieporowaty stały tlenek metalu, najczęściej cyrkonu (ZrO2) stabilizowany tlenkiem itru (Y2O3) 80 120 Ok. 200 80 140 650 800 1000 Jony OH Jony wodoru Jony wodoru Jony węglanu Jony tlenu Paliwo Wodór, hydrazyna N2H4, metan Czysty wodór, gaz ziemny, metanol, biogaz. Paliwo poddane reformingowi zewnętrznemu Utleniacz Tlen (powietrze) Tlen (powietrze) Katalizator Platyna Sprawność (%) 40 50 Zakres mocy 100 W 200 kW Platyna 40 50 200 kW 10 MW Zastosowanie Badania kosmosu Źródła rozproszone Elektrolit Temperatura pracy, C Nośnik ładunku Stan opracowania Działające Działające Gaz ziemny, metanol, biogaz. Paliwo poddane reformingowi wewnętrznemu lub zewnętrznemu Tlen (powietrze), Dwutlenek Tlen (powietrze) węgla Platyna Nikiel > 60 40 50 > 100 MW 100 W 10 MW Napęd, Źródła Źródła scentralizowane rozproszone Wodór, wodór z reformingu Działające Prototypowe Gaz ziemny, biogaz. Paliwo poddane reformingowi wewnętrznemu lub zewnętrznemu Tlen (powietrze) Metatynian wapnia > 60 > 100 MW Źródła scentralizowane Prototypowe Rys. 6. Charakterystyka reakcji zachodzących w ogniwach paliwowych Ogniwa paliwowe, ze względu na temperaturę roboczą, dzielą się na niskotemperaturowe do 250°C, wysokotemperaturowe do 650°C (druga generacja) i wysokotemperaturowe do 1000°C (trzecia generacja). 3 Ogniwa paliwowe jako źródła energii elektrycznej i ciepła (J. Paska) Rys. 7. Charakterystyka napięciowo-prądowa typowego ogniwa paliwowego Teoretycznym maksimum napięcia dla wodorowo-tlenowego ogniwa paliwowego jest 1,23 V. Jest to napięcie niezbędne do rozłożenia wody na tlen i wodór w procesie elektrolizy. Różnica pomiędzy rzeczywistym napięciem ogniwa a teoretycznym maksimum (ok. 25% w stanie jałowym) wynika z wielu różnych czynników. 3. Wykorzystanie ogniw paliwowych Do zalet ogniw paliwowych można zaliczyć: Wysoką sprawność w szerokim zakresie obciążeń. Możliwość stosowania wielu paliw, jednak pod Niską emisję zanieczyszczeń i hałasu. warunkiem reformingu do czystego wodoru. Budowę modułową i związane z tym łatwość Uzyskiwanie ciepła, zarówno nisko-, jak i lokalizacji i krótki czas budowy obiektu. wysokotemperaturowego. Korzystne cechy eksploatacyjne, w tym: możliwość szybkich zmian obciążenia, niewielki zakres remontów, możliwość automatyzacji. Oczywiście ogniwa paliwowe mają też wady. Do najważniejszych należą: Wysokie koszty inwestycyjne. eksploatacji osiąga 40 50 tys. godzin (5 7 lat) a Ciągle jeszcze niezbyt wysoka trwałość. Możliwy do czas nieprzerwanej pracy przekroczył 8000 godzin. uzyskania czas życia obiektu z ogniwami Czas potrzebny na „rozruch” ogniwa paliwowego. paliwowymi z pewnością będzie znaczne krótszy Degradacja właściwości ogniwa w miarę jego niż dla innych technologii generacji rozproszonej. eksploatacji. Najlepsze jak dotąd wyniki uzyskano dla ogniw z Występowanie korozji w przypadku elektrolitów kwasem fosforowym (PAFC), dla których czas ciekłych. Technologia ogniw paliwowych cieszy się ogromnym zainteresowaniem. Już dziś istnieje cały szereg aplikacji, w których wykorzystano ten rodzaj źródła energii. Pierwszą grupę stanowią ogniwa, które znalazły zastosowanie w układach napędowych, przede wszystkim dla przemysłu motoryzacyjnego. Do drugiej grupy należą ogniwa, które znalazły zastosowanie jako źródło energii dla urządzeń przenośnych (telefony komórkowe, laptopy, kamery cyfrowe, przenośne aplikacje wojskowe, małe przenośne generatory do 1 kW). Trzecia grupa ogniw znalazła zastosowanie w dużych systemach stacjonarnych (generacja rozproszona) o mocach od kilkudziesięciu kW do pojedynczych MW. Rys. 8. Schemat poglądowy układu hybrydowego z ogniwem SOFC i turbiną gazową: S – sprężarka, T – turbina gazowa, KS – komora spalania (dopalania), R - reaktor reformingu, Pal. – paliwo (np. gaz ziemny), DC/AC – prąd stały/zmienny, Q – ciepło do reformingu, 1 – kocioł odzyskowy, 2 - regenerator 4