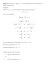9 kinetyka chemiczna 2
Transkrypt
9 kinetyka chemiczna 2
9 KINETYKA CHEMICZNA 2 Prawo działania mas. Szybkość reakcji chemicznych. Reakcje zerowego, pierwszego i drugiego rzedu. Cząsteczkowość i rzędowość reakcji chemicznych. Czynniki wpływające na szybkość reakcji (stężenie, temperatura). Energia aktywacji. Równanie Arrheniusa. Kataliza homogeniczna i heterogeniczna. Katalizatory i inhibitory. Autokataliza. Izobara Vant’t Hoffa. Hydroliza sacharozy. Pomiar stałej szybkości reakcji I rzędu. Zagadnienia teoretyczne 1. Wprowadzenie Zgodnie z definicją szybkość reakcji jest to zmiana stężenia cząsteczek podzielona przez czas, w którym ta zmiana zachodzi. Wszystkie wartości szybkości są dodatnie. Szybkość większości reakcji maleje w miarę zużywania się substratów, co przedstawia Rys. 1. stężenie, mol/l 0,10 — 0,08 — 0,06 — 0,04 — 0,02 — 0 | 10 | 20 Czas, tygodnie | 30 Rys. 1. Przedstawia on zmianę aktywności (zmianę stężenia) penicyliny, przechowywanej w temperaturze pokojowej bez stabilizatorów. Aktywność zmniejsza się w ciągu paru tygodni. Kształt tego wykresu – zależności stężenia penicyliny od czasu jest typowy dla przebiegu reakcji chemicznej, mimo, że przedział czasu może się zmieniać od ułamków sekund do lat. W wykresu wynika ponadto, że stężenie substratu zmienia się szybciej na początku reakcji niż pod jej koniec. W końcu reakcji cały substrat zanika. Podobne uwagi odnoszą się do stężenia produktów. Przypuśćmy, że chcemy wyznaczyć szybkość reakcji po 5 tygodniach od rozpoczęcia doświadczenia z penicyliną. Szybkość zmienia się z czasem, a więc jeśli wykorzystamy szybkość w momencie początkowym, (0) i w dziesiątym tygodniu do obliczenia nachylenia, uzyskamy jedynie średnią wartość, 5,6 mmol/l na tydzień (Rys. 2). Stężenie, mol/l 0,08 — 0,06 — 0,04 — 0,02 — 0 | 5 | 10 | 20 | 30 czas, tygodnie Rys. 2. Nieco inną wartość średnią otrzymamy, gdy zastosujemy stężenia po 2,5 i 7,5 tygodniach do obliczenia nachylenia – 6,2 mmol / l na tydzień. Aby wyznaczyć szybkość reakcji w określonym momencie (na przykład po 5 tygodniach), rysujemy styczną do krzywej w interesującym nas punkcie (Rys. 3). molowe stężenie produktu B styczna A ∆ (czas) Rys. 3. Na przykład szybkość w 5,0 tygodniu wynosi 6,8czas mmol/(l tydzień). Nachylenie tej linii prostej nazywane jest chwilową szybkością reakcji w określonym momencie (Rys.4). stężenie molowe N2O5, mol/l 0,08 — 5 0,06 — 4 0,04 — 3 0,02 — 2 1 czas Rys. 4 1. Równanie kinetyczne Aby zrozumieć jak zachodzą reakcje, można określić wzory na początkową szybkość reakcji tzn. chwilową szybkość na samym początku reakcji (styczną w punkcie startu). Załóżmy, że do 7 zlewek o pojemności 100 ml odważyliśmy 7 porcji po 500 mg opiłków magnezowych. Ponieważ odważki proszku / pyłu są jednakowe, powierzchnia jest proporcjonalna do ciężaru, zatem w każdej reakcji powierzchnia będzie identyczna, w konsekwencji stężenie Mg jest stałe. Zmiana szybkości reakcji będzie spowodowana zmianą stężenia dodawanego kwasu. Badana reakcja przebiega zgodnie z równaniem: Mg(s) + 2H+(aq) = H2(g) + Mg2+(aq) Szybkość reakcji można określić równaniem: V = k · [H+]a gdzie „a” określa rząd reakcji. (1) (2) Ponieważ stężenie magnezu w doświadczeniu jest stałe, zatem można przyjąć, że prędkość jest proporcjonalna do odwrotności czasu, V ~ 1/t, zatem 1/t = k · [H+]a Logarytmując obustronnie otrzymamy: log (1/t) = log (k · [H+]a) (3) log (1/t) = log k + a · log [H+] (4) Ponieważ ostatnie równanie przedstawia linie prostą, stosując metodę graficzną można wyznaczyć stałą szybkości reakcji k i rząd reakcji „a”. Nachyleniu „m” w równaniu linii prostej y = mx + b odpowiada rząd reakcji „a”, natomiast rzędnej „b” odpowiada log k. Oprócz metody graficznej do wyznaczania stałych równania linii prostej można zastosować metodę najmniejszych kwadratów. Wykonanie ćwiczenia 9. KINETYKA CHEMICZNA KINETYKA ROZTWARZANIA OPIŁKÓW MAGNEZU W ROZTWORACH KWASU SOLNEGO Zadania: 1. Zmierzyć czas roztwarzania opiłków magnezu pod wpływem działania kwasu solnego 2. Wyznaczyć rzędowość reakcji korzystając z wykresu: log1/t = f (log [H+]). UWAGA: Pomiary wykonujemy w okularach ochronnych. 1. Przygotowujemy w kolbkach miarowych (o poj. 50 ml) 7 roztworów HCl w ilości 50 ml każdy o stężeniach podanych w Tabeli 1. Roztwory sporządzamy poprzez rozcieńczenie 5 M roztworu HCl wodą destylowaną. 2. Odważamy w 7 zlewkach (o poj. 100 ml) 7 porcji po 300 mg każda opiłków metalowych magnezu (MMg = 24 g/mol). 3. Wlewamy kolejno roztwory HCl do zlewek z opiłkami magnezu i rozpoczynamy pomiar czasu (stoperem), lekko mieszając roztwór bagietką. Pomiar czasu kończymy w momencie rozpuszczenia wszystkich opiłków. 4. Uzyskane wyniki zapisujemy w Tabeli 1. 6. Rysujemy wykres zależności: log 1/ t = f ( log [H+] ). Tabela 1. Nr próbki [HCl] 1 0,5 M 2 1,0 M 3 1,5 M 4 2,0 M 5 2,5 M 6 3,0 M 7 3,5 M log [H+] Czas, t [sek] 1/t log (1 / t) Chwilowa szybkość reakcji Szybkość chwilową obliczamy korzystając ze wzoru (2) oraz z wartości stałej k wyznaczonej graficznie lub rachunkowo oraz ze stałej a określającej rząd reakcji. Przykładowy wykres. log (1/t) vs. log [HCl] log (1/t), szybkość, -1.00 -0.50 0.0 0.00 -2.0 0.50 , y = 2,6926x - 2,1491 -4.0 -6.0 log [C], stężenie, kwas solny 1.00