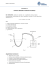termometr gazowy - Zakład Termodynamiki
Transkrypt
termometr gazowy - Zakład Termodynamiki
Katedra Silników Spalinowych i Pojazdów ATH ZAKŁAD TERMODYNAMIKI Termometr gazowy. Wyznaczanie współczynnika rozprężliwości dla powietrza. -1- Wprowadzenie teoretyczne Przy ogrzewaniu lub oziębianiu gazów mamy do czynienia z ich rozszerzalnością termiczną, która wyraża się zmianą parametrów stanu gazowego- objętości V, ciśnienia p i temperatury t. Stosuje się tu równanie stanu gazów doskonałych: pV = p0V0(1 + αt) (1) gdzie p0, V0 odnoszą się do stanu gazu w temperaturze t=0°C, p, V odnoszą się do stanu w temperaturze t≠0°C, α - współczynnik rozszerzalności gazów = 1/273K = 0,003661/K. Przypomnijmy, że gazem doskonałym nazywamy gaz o wyidealizowanych w stosunku do gazu rzeczywistego właściwościach: cząsteczki są tak małe, że można je traktować jak punkty materialne, siły międzycząsteczkowe nie istnieją. Procesy, w których parametry stanu ulegają zmianom nazywamy przemianami gazowymi. Szczególne znaczenie mają te przemiany, w których jeden z parametrów zachowuje wartość stałą. Przy zmianach temperatury gazu mogą być brane pod uwagę przemiany izobaryczne (p=idem) oraz przemiany izochoryczne (V=idem). Dla tych przemian wprowadza się równania stanu (1) dwa równania: V = V0 (1+αt), p=idem (2) p = p0 (1+αt), V=idem (3) Równanie (2) wyraża prawo Gay-Lussaca, równanie (3) - prawo Charlesa. Zarówno przemiany izobaryczne, jak i izochoryczne mogą być podstawą do pomiaru temperatury. Przyrządy wykorzystujące w tym celu jedną lub drugą przemianę nazwane są termometrami gazowymi. Mogą być: termometry gazowe izobaryczne, które są bardzo bliską analogią termometrów cieczowych; termometry gazowe izochoryczne. Ponieważ pomiar przyrostu objętości przy zmianach temperatury jest bardziej kłopotliwy niż pomiar przyrostu ciśnienia, w praktyce laboratoryjnej stosowane są termometry gazowe izochoryczne, których działanie oparte jest na prawie Charlesa. Zasada pomiaru Dla znalezienia ciśnienia p powietrza zamkniętego w bańce A (rys.1) należy wyznaczyć różnicę poziomów h rtęci między lewym i prawym ramieniem manometru. Ciśnienie p określone jest zależnością: -2- p = pA ± ph (4) gdzie pA oznacza ciśnienie atmosferyczne odczytane na barometrze, a ph – ciśnienie h [mm] słupa rtęci. Rys.1. Termometr gazowy Należy stale pamiętać o tym, aby poziom rtęci w lewym ramieniu a manometru dotykał do kolca K, co zapewni nam utrzymanie stałej objętości gazu. Po zanurzeniu bańki A w naczyniu z wodą, w której umieszczony jest termometr T, przesuwamy prawe ramię b manometru tak, aby poziom rtęci w lewym ramieniu a manometru dotykał do kolca K, po czym odczytujemy różnicę poziomów h (rys.2). Na podstawie zależności (4) znajdujemy ciśnienie p1 powietrza zamkniętego w zbiorniku A. Dla określenia stanu gazu potrzebna jest jeszcze temperatura t1, którą odczytujemy z termometru T. Otrzymane wyniki, dotyczące stanu początkowego gazu, zapisujemy w tabelce. Ogrzewamy teraz naczynie z wodą, przez co podwyższamy temperaturę powietrza w bańce o kilka stopni (ok. 10°C); zachowując warunek izochoryczności- przez doprowadzenie poziomu rtęci w ramieniu lewym do kolca K- odczytujemy różnicę poziomów h. Wyznaczamy z równania (4) ciśnienie p2 odpowiadające temperaturze t2 odczytanej na termometrze T. Postępując tak samo ogrzewamy wodę w naczyniu skokami, co kilka stopni, aż do wrzenia wody i za każdym razem wyznaczamy ciśnienie powietrza. -3- Opracowanie wyników pomiarów. Otrzymane wyniki pozwalają na sporządzenie wykresu (rys. 2) przemiany izochorycznej. Rys.2. Wykres przemiany izochorycznej gazu - ekstrapolacja do temperatury zera bezwzględnego. Przedłużmy linię wykresu w stronę temperatur ujemnych, aż do przecięcia z osią temperatur. W punkcie przecięcia E (rys. 3), ciśnienie gazu jest równe zeru, a temperatura, w której ten stan został osiągnięty, nosi nazwę temperatury zera bezwzględnego tb. Odwołując się do równania (3) otrzymujemy zależność, która pozwoli na wyznaczenie współczynnika prężności α na podstawie odczytanej na wykresie temperatury tb: α =− 1 tb Ten sposób wyznaczenia α można nazwać sposobem graficznym. Istnieje możliwość wyznaczenia tego współczynnika bez wykresu. Z tabelki obserwacji odczytujemy dane dotyczące temperatury i ciśnienia w stanie początkowym (t1,p1) i w stanie końcowym (t2,p2). W oparciu o wyrażone równaniem (3) prawo Charlesa otrzymujemy: α = p 2 − p1 p1t 2 − p 2 t1 -4-