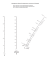międzycząsteczkowych
Transkrypt
międzycząsteczkowych
Kształcenie nauczycieli chemii Niektóre rodzaje oddziaływań międzycząsteczkowych a właściwości substancji Artykuł ten przedstawia krótką charakterystykę niektórych rodzajów sił działających tylko między elektrycznie obojętnymi drobinami chemicznymi i ich związek z wybranymi właściwościami substancji. WŁODZIMIERZ KUŚMIERCZUK początkowym okresie nauczania chemii, już na etapie gimnazjum, uczeń poznaje podstawowe właściwości substancji. Opis makroskopowy przeplata się tu z mikroskopowym. Początkowo zjawiska fizyczne interpretuje on na podstawie zachowania drobin w ich zbiorze. Później na podstawie cech budowy samych drobin i praw określających ich zachowanie przewiduje te właściwości. Pozytywna weryfikacja hipotez umacnia jego wiarę w słuszność poznawanych teorii i własne możliwości intelektualne. Ponieważ prawa fizyki dotyczące mikroświata są skomplikowane, a narzędzia stosowane w szkole do opisu i interpretacji zjawisk molekularnych powinny być dostatecznie proste, wnioskowanie powinno mieć charakter raczej ogólny, albo wręcz ogólnikowy. Prymitywne modele pozwalają jednak formułować ogólne zasady. Przykłady ilustrujące je powinny być dobierane z rozwagą, bo rozpatrywanie szczegółowych różnic właściwości dwóch przypadkowych substancji niesie ryzyko natrafienia na rozbieżności między wnioskami z tzw. ,,teorii” i faktami. Wyjaśnienie różnic właściwości fizycznych substancji o podobnym typie budowy może być dla ucznia trudne, zaś przewidywanie kierunku ich zróżnicowania jeszcze trudniejsze. Jednym z istotnych problemów jest tu ocena wielkości wkładu poszczegól- W 3/2006 nych rodzajów oddziaływań międzycząsteczkami. Obraz sił międzycząsteczkowych przybliża się zazwyczaj wybierając jako model wodę, a następnie przenosi się go na inne substancje. W taki sposób anomalny przypadek staje się wzorcem i podstawą nieuprawnionych uogólnień. Artykuł ten przedstawia krótką charakterystykę niektórych rodzajów sił działających tylko między elektrycznie obojętnymi drobinami chemicznymi i ich związek z wybranymi właściwościami substancji. Nie będą tutaj omawiane wiązania jonowe, siły oddziaływania jonów z cząsteczkami, najsilniejszy rodzaj oddziaływań obojętnych elektrycznie cząsteczek – wiązania wodorowe, ani oddziaływania elektronowo-donorowo-akceptorowe, prowadzące do tzw. kompleksów charge-transfer. Siły międzycząsteczkowe noszą nazwę sił van der Waalsa na cześć twórcy koncepcji tych sił, Johannesa Diderika van der Waalsa (nagroda Nobla z fizyki – 1910). Określenie to jest często odnoszone tylko do sił oddziaływania chwilowych dipoli, co może prowadzić do nieporozumień. Na siły van der Waalsa składa się kilka rodzajów oddziaływań, w tym także wiązanie wodorowe. Ponieważ to ostatnie jest najsilniejsze i w substancjach, w których występuje 15 Kształcenie nauczycieli chemii ma największy wpływ na właściwości, wymagałoby szczegółowego potraktowania i zasługuje na odrębny artykuł. Pozostałe oddziaływania nazywane są od nazwisk fizyków, którzy pierwsi podali ich szczegółowy opis. Zależność siły od odległości jest dla nich zróżnicowana, podobnie jak zależność od temperatury. Ponieważ są to siły elektryczne, to można dla ich pola określić choćby przybliżony potencjał V, to jest funkcję po zwalającą wy→ → znaczyć natężenie pola E (E=-dV/dr), siłę oddziaływania i energię potencjalną związaną z tym oddziaływaniem. Pole tych sił nie jest centralne, tak jak w przypadku pola ładunku punktowego. Zmienia się nie tylko wraz z odległością, ale też w zależności od kierunku w przestrzeni. Nawet dla najsłabszych oddziaływań, jakimi ze względu na potencjał są siły dyspersyjne, suma sił przyciągania i ich wkład w energię są zazwyczaj większe, niż tych związanych z trwałymi momentami dipolowymi cząsteczek. Siły elektryczne działające między cząsteczkami prowadzą do ich przyciągania, lecz gdy odległości między nimi maleją tak, że obszary elektronowe zachodzą na siebie (cząsteczki zaczynają stykać się), dominuje efekt odpychania. Potencjał sił międzycząsteczkowych powinien uwzględniać oba rodzaje oddziaływań. Wkład w siłę przyciągania ma trzy rodzaje efektów: • Efekt orientacyjny, tj. oddziaływania pomiędzy trwałymi dipolami elektrycznymi cząsteczek. Energia tych oddziaływań nosi nazwę energii Keesoma (EK). • Efekt indukcyjny, tj. oddziaływanie trwałych dipoli i indukowanych przez nie w sąsiednich cząsteczkach chwilowych dipoli. Energia tych oddziaływań nazywa się energią Debye’a (ED). • Efekt dyspersyjny, zwany siłami Londona. Są to oddziaływania chwilowych dipoli z indukowanymi przez nie w sąsiednich cząsteczkach dipolami, a ich energia oznaczona jest EL. 16 Efekt orientacyjny (dipol–dipol) Energia oddziaływania dwóch trwałych dipoli zależy od wartości ich momentu dipolowego, odległości i wzajemnej orientacji. Energia związana z przyciąganiem jest ujemna, zaś z odpychaniem dodatnia. Gdyby wszystkie możliwe orientacje dipoli były jednakowo prawdopodobne, to energia ta wynosiłaby zero. Siły elektrycznych oddziaływań dipoli sprawiają, że cząsteczki w gazach i w cieczach zmieniają wzajemne położenia, a orientacje odpowiadające niższym energiom są w danej temperaturze bardziej prawdopodobne. Dla gazów energia potencjalna dwóch dipoli jest proporcjonalna do kwadratów ich momentów dipolowych i maleje z odległością jak 1/r6, a siła między nimi jak 1/r7. Wielkości te są odwrotnie proporcjonalne do temperatury i maleją wraz z jej wzrostem. Wyższa temperatura zwiększa prawdopodobieństwo tego, że dipole zwrócone są ku sobie biegunami jednoimiennymi, a to prowadzi do odpychania. Dla ciał stałych, gdzie rotacja dipoli jest zahamowana, energia zmienia się jak 1/r3 i jest od temperatury niezależna. Wkład tych oddziaływań w energię zależy zatem od stanu skupienia substancji! Szczegóły dotyczące ich charakterystyki znajdzie czytelnik w podręcznikach chemii fizycznej, np. w [1]. Oprócz sił dipol–dipol znaczenie dla właściwości układów cząsteczek mogą mieć siły działające między innymi multipolami. Cząsteczka CO2 jest pozbawiona momentu dipolowego, lecz jej atomy posiadają ładunki cząstkowe (jest ona kwadrupolem). Stąd m.in. bierze się duża różnica w rozpuszczalności w wodzie dwutlenku węgla (siły dipol–kwadrupol) i tlenu, którego cząsteczki nie oddziałują w ten sposób. Efekt indukcyjny (dipol trwały–dipol indukowany) Energia tego oddziaływania zmienia się z odległością również jak 1/r6, ale w przeciwieństwie do energii Keesoma nie zależy od temperatury. Parametrem cząsteczki niepolarnej mającym wpływ na tę część chemia w szkole Kształcenie nauczycieli chemii energii jest jej polaryzowalność α, zaś cząsteczki polarnej jej moment dipolowy. Polaryzowalność jest miarą zdolności odkształcania chmury elektronowej cząsteczki/atomu pod wpływem zewnętrznego pola elektrycznego. Im elektrony w drobinie związane są słabiej, tym jest większa. Na polaryzowalność wpływ mają rozmiary atomów/cząsteczek, kształt cząsteczek, obecność w nich wolnych par elektronowych, wiązań π, możliwość delokalizacji elektronów. Im atom lub cząsteczka są większe, tym większa jest ich polaryzowalność. W niektórych źródłach można znaleźć stwierdzenie, że siły międzycząsteczkowe i związane z nimi temperatury wrzenia substancji rosną wraz z masą drobin. Jest to zbieżność wynikająca z korelacji, gdyż rosnącym rozmiarom atomów i cząsteczek towarzyszy wzrost ich masy. Siły elektromagnetyczne nie są zależne od masy. Temperatury wrzenia wodoru zmieniają się od diprotu, poprzez dideuter do ditrytu nieznacznie (20, 23 i 25 K), podczas gdy wzrost masy jest dwu- i trzykrotny. Rozmiary tych cząsteczek wodoru także nieznacznie rosną w tym kierunku [2]. Masa cząsteczek jest parametrem, który wpływa na rozkład ich prędkości i powinien być on uwzględniany przy rozpatrywaniu zjawisk związanych z temperaturą. W określonej temperaturze cząsteczki o mniejszej masie mają większą średnią prędkość kwadratową. Duża prędkość cząsteczki może umożliwić jej ucieczkę poza obszar sił przyciągania grawitacyjnego, ale niekoniecznie elektrycznego. Tutaj należy rozpatrywać jej energię kinetyczną (dodatnią) i energię potencjalną związaną z siłami przyciągania (ujemną). Dla pewnych cząsteczek polaryzowalność może być silnie zróżnicowana w zależności od kierunku (jest wielkością tensorową) i wielkość sił związanych z polaryzowalnością zależy silnie od wzajemnego położenia cząsteczek. Ten rodzaj siły przyciągania nie zależy od temperatury, ponieważ dipol indukowany jest zawsze w zgodnej fazie, niezależnie od chwilowej wzajemnej orientacji cząsteczek. 3/2006 Efekt dyspersyjny, czyli siły Londona (chwilowy dipol–dipol indukowany) Jest to jedyny rodzaj sił przyciągania jaki występuje między atomami helowców i niepolarnymi cząsteczkami, ale występuje między wszystkimi rodzajami cząsteczek. Rozkład elektronów ulega chwilowym zaburzeniom (fluktuacjom), co prowadzi do powstania w cząsteczce chwilowego momentu dipolowego, a ten indukuje w cząsteczkach sąsiednich zgodne w fazie momenty dipolowe. Prowadzi to zawsze do przyciągania cząsteczek. Wielkość tego oddziaływania zależy od polaryzowalności cząsteczek, ich odległości i wielkości ich energii jonizacji. Nazwa efekt dyspersyjny pochodzi stąd, że ten sam ruch elektronów powoduje rozpraszanie (dyspersję) światła, i odpowiada za dyspersję współczynnika załamania światła (zależność od częstotliwości promieniowania). Siły odpychania między cząsteczkami zaczynają działać, gdy odległości między nimi zaczynają się zbliżać do sumy ich promieni i gwałtownie rosną, gdy odległość ta maleje. Energia odpychania przedstawiana jest za pomocą członu Erep = +k/r12, lub –b/r wyrażenia wykładniczego Erep = ae , gdzie k, a i b to wyznaczane doświadczalnie stałe. Całkowita energia potencjalna będąca sumą energii przyciągania i odpychania postaci k/r12 nazywa się potencjałem lub 17 Kształcenie nauczycieli chemii funkcją Lennarda-Jonesa. Funkcja ta ma przebieg przedstawiony na rysunku. Krzywa leżąca pod osią (ujemne wartości energii) przedstawia energię potencjalną związaną z siłami przyciągania. Energię potencjalną odpychania (dodatnią) przedstawia krzywa nad osią (energie dodatnie). Krzywa ta ma płytkie minimum i jest silnie asymetryczna. Asymetria potencjału oddziaływań międzycząsteczkowych wyjaśnia zjawisko rozszerzalności temperaturowej cieczy i ciał stałych. Rosnącym temperaturom odpowiadają stany energii położone wyżej, co sprawia, że odległości równowagowe drobin zwiększają się. na. Ponieważ często występują między cząsteczkami różne rodzaje oddziaływań, to związek między określoną właściwością a cechami budowy drobin jest złożony. Proste reguły w rodzaju: ,,substancje polarne charakteryzują większe siły międzycząsteczkowe niż substancje niepolarne” są zazwyczaj nieprawdziwe. Niektóre parametry cząsteczek, udział poszczególnych rodzajów oddziaływań w wybranych substancjach i ich temperatury wrzenia (na podstawie [2] i [1]) przedstawione są w tabeli poniżej. Temperatury wrzenia i entalpie parowania Ponieważ dla wielu cieczy stosunek molowej entalpii parowania do temperatury wrzenia jest mniej więcej stały i wynosi ok. 85 JK-1mol-1 (reguła Troutona), dlatego zależność obu tych wielkości od sił międzycząsteczkowych jest taka sama i będę odnosił się wyłącznie do temperatur wrzenia. Substancje, w których występują wiązania wodorowe wykazują od tej reguły znaczne odchylenia! Wzrost temperatury wrzenia substancji związany jest ze wzrostem sił przyciągania jej drobin. Dla gimnazjalisty to wartościowy wniosek, a w dodatku prawdziwy. Kiedy przechodzimy w dalszym nauczaniu do związku tej wielkości z budową cząsteczek, powinna zapalić się nam czerwona lampka. Anomalnie wysokie temperatury wrzenia wody i fluorowodoru wyjaśniamy Siły międzycząsteczkowe a właściwości substancji Poprawna interpretacja zjawisk cząsteczkowych wymaga pewnego doświadczenia i intuicji chemicznej. W pewnych sytuacjach najsłabsze oddziaływania można zaniedbać, w innych nie. Za zjawiska skraplania i różnice temperatur wrzenia helowców odpowiedzialne są siły Londona, jedyny tu rodzaj oddziaływań. Dla silnie polarnych cząsteczek o małych rozmiarach wystarczy uwzględnić tylko siły przyciągania trwałych dipoli, np. w H2O (ale uwaga: pominięto tu najistotniejszy wkład wiązań wodorowych). W przypadku większych polarnych cząsteczek (HI), lub takich o niewielkich momentach dipolowych (CO), siły Keesoma są mało znaczące i dominują tu siły Londosubstancja 18 moment dipolowy, [ D ] (1D= 3,336 · 10-30 C · m) EK, % ED,% EL, % 100 Ar 0 0 0 CO 0,11 0,005 0,084 HI 0,42 0,09 HBr 0,79 3,33 HCl 1,08 NH3 H2O względne polaryzowalności temperatura wrzenia [K] 1,66 87,3 99,911 1,98 81,7 0,44 99,47 5,45 237,8 2,18 94,49 3,61 206,4 14,4 4,2 81,4 2,63 191,1 1,46 44,9 5,3 49,8 2,22 238,8 1,86 76,9 4,1 19,0 1,48 373,2 chemia w szkole Kształcenie nauczycieli chemii obecnością silnych wiązań wodorowych, zaś wyjaśnienie regularnego wzrostu temperatur wrzenia kolejnych wodorków tlenowców i fluorowców zbywa się zazwyczaj stwierdzeniem, że jest to efekt wzrostu ich masy cząsteczkowej, nie wyjaśniając fizycznej przyczyny (podobnie jak w przypadku zmian temperatur wrzenia w szeregach homologicznych). Regularności te wynikają ze wzrostu rozmiarów cząsteczek i związanego z tym wzrostu ich polaryzowalności, a to prowadzi do zwiększenia sił Londona. Cząsteczki homologicznych związków mają podobną budowę elektronową i podobny kształt. Wartości momentów dipolowych nie odgrywają tu znaczącej roli (patrz tabela). Cząsteczki CH3-CH3 i CH3-F są izoelektronowe, mają podobne rozmiary i kształt, natomiast temperatury wrzenia substancji wynoszą: 184,5 oraz 194,7 K. Przyczynę różnicy łatwo tu zidentyfikować (trwały moment dipolowy fluorometanu) i taką różnicę można przewidzieć. Dla kolejnej pary substancji CHCl3 (Twrz = 334,4 K, µ = 1,04 D) i CCl4 (Twrz = 350 K, µ = 0 D) zestawienie wartości jest dla ucznia, któremu wmówiono, że cząsteczki polarne przyciągają się silniej, zaskakujące. Dominacja w tych substancjach sił dyspersyjnych jest oczywista, a różnica temperatur wrzenia wynika z różnicy polaryzowalności, która dla cząsteczki o większej liczbie elektronów i wyższej symetrii jest większa. Wpływ kształtu cząsteczek na temperaturę wrzenia ilustruje się na doskonałym modelu, jakim są izomery alkanów. Ich cząsteczki są izoelektronowe, różnice momentów dipolowych znikome – idealna sytuacja do porównywania. Cząsteczkom o wydłużonym kształcie (n-alkany) odpowiadają temperatury wrzenia wyższe niż ich rozgałęzionym i bardziej bryłowatym izomerom, ponieważ gdy cząsteczki mają kształt wydłużony, to w ułożeniu równoległym większa liczba atomów może znaleźć się w bezpośredniej bliskości i siły dyspersyjne są większe. Gdy cząsteczki dwóch substancji różnią się kilkoma cechami, a zróżnicowanie nie 3/2006 jest drastyczne, to prognozowanie relacji między temperaturami wrzenia staje się ryzykowne. Kiedyś napotkałem taki problem rozwiązując z uczniami zadanie egzaminacyjne na akademie medyczne. Wybór poprawnej odpowiedzi sprowadzał się ostatecznie do rozstrzygnięcia, która z substancji, etan czy eten ma niższą temperaturę wrzenia. Jak mogłoby wyglądać rozumowanie prowadzące do rozstrzygnięcia? Obie cząsteczki są niepolarne i jedynym rodzajem sił są siły dyspersyjne. Cząsteczka C2H6 ma o dwa elektrony więcej i ma kształt cylindryczny, podczas gdy C2H4 jest prostokątna. To przemawiałoby za wyższą polaryzowalnością C2H6, ale obecność łatwiej polaryzowalnych elektronów π w C2H4 osłabia to przekonanie. Temperatura wrzenia etenu jest niższa (–104°C) niż etanu (–89°C), ale czy fakt ten przypisać słabszym siłom przyciągania, czy też może większym siłom odpychania związanym z elektronami π w etenie? Ten ostatni argument można podważyć, gdyż etyn, który posiada dwie takie pary elektronowe, wrze w wyższej temperaturze (–84°C) niż etan, czyli siły Londona są tu jeszcze większe. Czynnikiem decydującym wydaje się zatem kształt cząsteczki, a w dalszej kolejności wpływ elektronów π na polaryzowalność, lecz w żadnym wypadku nie jest nim masa (brak korelacji dla tych trzech cząsteczek) – a to zapewne miał w intencjach autorów zadania uwzględnić kandydat na medyka. Argumentem wzmacniającym tę tezę są temperatury wrzenia buta-1,2-dienu (10,3°C, układ liniowy atomów węgla) i buta-1,3-dienu (–4,5°C, układ przestrzenny). Rozpuszczalność a siły międzycząsteczkowe ,,Podobne rozpuszcza podobne” – powszechnie przytaczana w podręcznikach reguła jest tak lapidarna, że musi być przez autora lub nauczyciela skomentowana. Podobieństwa jakiej cechy cząsteczek rozpuszczalnika i substancji rozpuszczanej ma dotyczyć? Niestety, najczęściej spotyka się taką wykładnię, że polarne rozpuszczalniki 19 Kształcenie nauczycieli chemii rozpuszczają substancje polarne, zaś w rozpuszczalnikach niepolarnych rozpuszczają się substancje niepolarne. O przykłady ilustrujące taki punkt widzenia nietrudno, ale można wskazywać też kontrprzykłady. Najpospolitszym polarnym rozpuszczalnikiem jest woda, w której najsilniejszym rodzajem oddziaływań są wiązania wodorowe, a nie dipol–dipol. Jeżeli drobiny substancji rozpuszczanych nie tworzą z wodą wiązań wodorowych ani połączeń o charakterze kompleksów, to nawet jeśli ich cząsteczki mają spory moment dipolowy, jak w przypadku CH2Cl2 (µ = 1,62 D), czy nitrobenzenu (µ = 4,23 D), to ich rozpuszczalność jest mała. Silnie polarne, ale duże cząsteczki nitrobenzenu, przenikając między cząsteczki wody, powodowałyby zrywanie większej liczby wiązań wodorowych, niż same byłyby zdolne utworzyć, a to prowadziłoby do wzrostu energii układu. Efekt energetyczny decyduje o tym, że wiele związków jonowych (skrajnie polarnych) w wodzie nie rozpuszcza się. Z kolei całkowicie niepolarny BF3 rozpuszcza się w wodzie (w gorącej dobrze). Innymi przykładami substancji niepolarnych, które dobrze rozpuszczają się silnie polarnym kwasie siarkowym(VI) są SO3 i alkeny. W obu przypadkach tworzą się połączenia z cząsteczkami rozpuszczalnika o charakterze wręcz addycyjnym i energia roztworu jest niższa od sumy energii obu substancji. Polarny etanol (µ = 1,66 D) rozpuszcza się nieźle w niepolarnej benzynie (10% gashol) i to również jest wytłumaczalne. Przykłady można mnożyć, zatem to nie wartość momentu dipolowego przesądza o zdolności rozpuszczania. Wyjaśnieniem kierunku przebiegu wszelkich procesów, w tym rozpuszczania, są prawa termodynamiki, ale w nauczaniu na poziomie podstawowym ten sposób nie jest możliwy do zastosowania. Moim zdaniem właściwiej jest mówić o siłach przyciągania cząsteczek i związanej z nimi energii i przy ich pomocy wyjaśniać zjawiska molekularne, a nie na podstawie takich cech jak polarność drobin czy jej brak. Model teoretyczny opisujący kieru- 20 nek procesu w stronę mieszania drobin różnych substancji, lub ich separacji, może być taki: Drobiny A i B mieszają się między sobą, o ile prowadzi to do zmniejszenia, lub tylko nieznacznego wzrostu energii układu. Oznacza to, że uśredniona (statystycznie) siła przyciągania dla pary drobin w mieszaninie jest większa lub tylko nieznacznie mniejsza, od średniej dla substancji A i B. Posługiwanie się siłą działającą na pojedynczą drobinę w tego typu sytuacjach fizycznych traci sens, bo w jaki sposób liczyć taką statystyczną wielkość? Jeżeli chcemy posługiwać się w argumentacji tą zrozumiałą dla ucznia wielkością, to zaznaczmy, że siłom przyciągania odpowiada ujemna energia potencjalna. Ponieważ mieszaniu drobin towarzyszy wzrost entropii, to opis za pomocą sił i związanej z nimi energii sprowadza się do zasady obniżania entalpii swobodnej, bez nazywania rzeczy po imieniu. Podobieństwo substancji dotyczy zatem charakteru oddziaływań międzycząsteczkowych w substancjach A i B, oraz w ich mieszaninie, i związanych z tymi oddziaływaniami energii (odniesionych do mola drobin), a nie stopnia polarności. Ponieważ korelacje między zdolnością rozpuszczania a polarnością (lub jej brakiem) są liczne, to zasada cytowana na początku paragrafu kusi swą prostotą. Co począć jednak z całym mnóstwem wyjątków? Jeżeli entalpia mieszania jest bliska zeru, to o samorzutności procesu mieszania drobin decyduje dodatnia wartość entropii mieszania: ∆Sm = –R (xAlnxA + xBlnxB); xA i xB są ułamkami molowymi składników mieszaniny jednorodnej. Opisana sytuacja dotyczy roztworów idealnych, a przybliżeniem takiej sytuacji jest rozpuszczanie niepolarnych substancji w niepolarnych rozpuszczalnikach. Podczas mieszania drobinowego mogą pojawiać się nowe rodzaje oddziaływań, nie występujące w czystej substancji, np. cząsteczki formaldehydu w wodzie tworzą wiązania wodorowe z cząsteczkami wody, a nawet produkty addycji. Zmienia się zasięg chemia w szkole Kształcenie nauczycieli chemii oddziaływań i liczba oddziałujących z jedną drobiną A innych drobin. Przewidywanie takich sytuacji wymaga już sporej wiedzy. Jeżeli rozpuszczaniu towarzyszy tworzenie wiązań chemicznych między A i B (odpowiada to także cytowanym wcześniej przykładom rozpuszczania niepolarnych substancji w polarnym rozpuszczalniku), to główny wkład w entalpię swobodną mieszania ma składnik entalpowy. Entropia może wówczas nawet maleć, jeżeli w roztworze tworzą się liczne addukty drobin. Temperatury topnienia Proces topnienia jest rezultatem przewagi energii dostarczonej kryształowi nad energią sieci krystalicznej. Jeżeli energia dostarczona przewyższa różnicę entalpii tworzenia substancji w stanie stałym i ciekłym, to topnienie zachodzi (czasami trzeba uwzględnić także czynnik entropowy). Entalpia topnienia i temperatura topnienia będą tym wyższe, im wyższa będzie ta różnica energii. Jeżeli kryształy molekularne zbudowane są z cząsteczek niepolarnych i jedynym rodzajem oddziaływań między nimi są siły Londona, to temperatury topnienia powinny rosnąć ze wzrostem tych sił, a więc wraz ze wzrostem ich rozmiarów. Taka tendencja występuje u gazów szlachetnych. Dla cząsteczek, które nie wykazują pełnej symetrii obrotowej, sytuacja komplikuje się, ponieważ siły dyspersyjne zależą bardzo mocno od odległości, a na to ma wpływ gęstość upakowania przestrzeni cząsteczkami. To sprawia, że temperatura topnienia jest bardzo silnie uwarunkowana kształtem cząsteczek. Temperatury topnienia n-alkanów wzrastają, gdy zwiększa się długość łańcucha, ale wzrost ten jest znacznie wyższy przy przejściu do alkanu o parzystej liczbie atomów węgla. Z kolei w szeregu kwasów n-alkanowych temperatury topnienia oscylują. Przyczyna jest ta, że dla rozciągniętej konformacji łańcucha obie skrajne grupy atomów skierowane są w przeciwnych kierunkach, gdy liczba atomów węgla jest parzysta, a to odpowiada mniejszej odległości między gru- 3/2006 pami atomów z sąsiadujących cząsteczek i większym siłom przyciągania. Cząsteczki benzenu są płaskie, o symetrii sześciokąta foremnego i ściśle pokrywają płaszczyznę. Siły Londona w benzenie są na tyle duże, że temperatura topnienia jest o 100°C wyższa niż toluenu, którego cząsteczka chociaż jest większa i ma niewielki moment dipolowy, nie jest już płaska i ma znacznie niższą symetrię, co sprawia, że upakowanie przestrzeni nie jest tak ścisłe jak w benzenie. Pofałdowane cząsteczki cykloheksanu również dobrze wypełniają przestrzeń, a większa liczba elektronów sprawia, że temperatura topnienia jest nawet nieco wyższa niż benzenu. Temperatury topnienia [°C] n-alkan kwas alkanowy C3 C4 C5 C6 –187,6 –138,3 –129,7 –95,3 –20,7 –4,3 –33,8 –3,9 benzen toluen cykloheksan +5,5 –95 +6.5 Jeżeli w kryształach występują dodatkowo oddziaływania trwałych dipoli lub wiązania wodorowe, to temperatury topnienia zwiększają się. Jak widać z kilku przedstawionych przykładów, zależność sił przyciągania (i temperatur topnienia) w kryształach molekularnych bywa mocno skomplikowana i nie za bardzo nadaje się do analizowania w szkole. Dane liczbowe dotyczące substancji zaczerpnięto z [3]. mgr WŁODZIMIERZ KUŚMIERCZUK uczy chemii w Gimnazjum Nr 3 oraz w I Społecznym Liceum Ogólnokształcącym w Zamościu. L ITERATURA [1]. P.W. Atkins: Chemia Fizyczna, Wydawnictwo Naukowe PWN, Warszawa 2001 [2]. J.E. Huheey: Inorganic Chemistry – Principles of structure and reactivity, Harper & Row, N.Y. 1974 [3]. Poradnik fizykochemiczny – praca zbiorowa, Wydawnictwa Naukowo Techniczne, Warszawa 1974 21