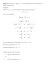pH, pOH, stężenia jonów wodorowych [Mateusz
Transkrypt
pH, pOH, stężenia jonów wodorowych [Mateusz
pH, pOH, stężenia jonów wodorowych [Mateusz Adam] grupa I/1 Zadanie 1. Iloczyn jonowy wody Kw wynika z przekształcenia równania na stałą autodysocjacji wody. Kw=K*[H2O]2 = [H3O+]*[OH-] Iloczyn jonowy wody ma wartość 10-14. Wynika z tego, że stężenie każdego z jonów powstałych w reakcji dysocjacji wody wynosi 10-7 – co za tym idzie pH = 7. W roztworach o pH>7 jest wyższe stężenie OH-, a w pH<7 stężenie H+. Iloczyn jonowy wody zależy od temperatury. Im wyższa temperatura, tym wyższy iloczyn. Zadanie 2. pH jest to skala, za pomocą można wyrazić stężenie jonów wodorowych w roztworze. Jest to ujemny logarytm z stężenia jonów wodorowych. Skala pH pozwala na odróżnianie odczynu chemicznego roztworu. Jeśli pH=0 – odczyn obojętny, pH>7 zasadowy; pH<7 kwasowy. Zadanie 3. Ponieważ skala pH została pierwotnie stworzona dla rozcieńczonych roztworów kwasów, zasad i soli. Wynika to z faktu, że w zakresie wyższych stężeń pH roztworu jest funkcją aktywności jego jonów. Kw=10-14 pH+pOH=-logKw=pKw=14 Dla wysokich stężeń roztworów kwasów i zasad, i dla roztworów kwasów i zasad w innych rozpuszczalnikach niż woda, nie stosuje się skali pH, lecz ujemny logarytm ze stałej równowagi dysocjacji – pKa, pKb. Superkwasami i superzasadami nazywamy takie związki, które mają to wartość bardzo małą. Zadanie 4. Wskaźniki to związki które zmieniają barwę pod wpływem kwasu lub zasady. Ulegają w roztworze dysocjacji kwasowej lub zasadowej i są słabymi elektrolitami. Zakres zmiany barwy wskaźników jednobarwnych zależy od całkowitego stężenia wskaźnika. Ze wzrostem stężenia jonów, powodujące zabarwienie, intensywność zabarwienia zwrasta. Zadanie 5. Wskaźniki wielobarwne – obecność kilku barw jest konsekwencją występowania kilku równowag protolitycznych, którym towarzyszy zmiana barw. Zadanie 6. Do roztworu kwasowego jest oddawana zasada. Następuje reakcji zobojętniania do momentu pojawienia się żółtego koloru. Następny dodawana ilość zasady powoduje, że roztwór ma odczyn zasadowy i kolor niebieski, pod wpływem błękitu tymolowego. Zadanie 7. Ka [Ind ] = [HInd ] [ H 3 O] K a =10−5 Roztwór będzie mieć barwę zieloną pH =7 [ H 3 O]=10−7 K a>[ H 3 O] [ Ind ]>[ HInd] Zadanie 8. Wskaźniki pH, metodą potencjometrycznej, metodą spektrofotometryczną (kolorymetryczną). Zadanie 9. a) pH = 3,92 [H]=10-3,92= 1,202264*10-4 b) pOH = 5,86 pH = 14- pOH = 14-5,86 = 8,14 [H]=10-8,14=7,244*10-9 Zadanie 10. I .[ H 3 O]1=7∗10−7 II .[OH ]=3∗10−8 K w =[ H 3O]2 [OH ] K Kwas I jest bardziej kwasowy. [ H 3 O]2= w [OH ] −14 10 [H 3 O]2= =3,33∗10−7 −8 (3∗10 ) Zadanie 11 KNO3 → K+ + NO3- brak powstawania H+ lub OH- ich stężenie nie wzrośnie: odczyn obojętny więc błękit bromotymolowy będzie zielony. Na2CO3 + H2O → CO2 + 2OH- + 2Na+ powstaną jony OH- stężenie ich wzrośnie: odczyn zasadowy więc błękit będzie niebieski. NH4Br + H2O → H+ + Br- + NH3 + H2O powstaną jony H+ stężenie ich wzrośnie: odczyn zasadowy, więc błękit będzie żółty. Zadanie 12. kwas [H ]=10−1 pH 1=−log [H 1 ] [H ] [ H 2]= 1 100 [H ] pH 2=−log 1 100 [H ] (−log 1 ) pH 2 100 = pH 1 (−log[ H 1 ]) 10−1 (−log ) pH 2 100 3 = = =3 −1 pH 1 (−log10 ) 1 pH 1=1 pH 2=3 zasada [OH ]=10−1 pOH 1=−log [OH 1 ] [OH 1 ] [OH 2 ]= 100 [OH 1 ] pOH 2=−log 100 [OH 1] (−log ) pOH 2 100 = pOH 1 (−log [OH 1]) 10−1 (−log ) pOH 2 100 3 = = =3 −1 pOH 1 (−log 10 ) 1 pH 1=13 pH 2=11 [Mateusz Adam] ==== Prawa zastrzeżone