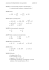Karta pracy IV/1a – Elektroliza
Transkrypt
Karta pracy IV/1a – Elektroliza
Karta pracy IV/1a – Elektroliza Przykładowe zadania z rozwiązaniami Zad. 1 W trakcie elektrolizy stopionego KOH na jednej z elektrod wydzieliło się 11,2dm3 bezbarwnego i bezwonnego gazu ( objętość mierzona w warunkach normalnych). Zapisz równania elektrodowe w elektrolizerze oraz oblicz, ile gramów potasu wydzieliło się na drugiej elektrodzie. Rozwiązanie: W trakcie stapiania wodorotlenków zachodzi ich rozkład wg równania: 2KOH K2O + H2O, stąd elektroliza zachodzi tak jak w przypadku elektrolizy stopionych tlenków. K2O 2K+ + O2 K (-): K+ + 1e- K 1 4 4 2 A (+): 2O O2 + 4e 4 1 z równań elektrodowych wynika, że na każdy mol (22,4dm3 - w warunkach normalnych) tlenu wydzielonego na anodzie, na katodzie następuje rozładowanie 4 moli potasu. 4 ∙ 39 g (potasu) ------------ 22,4 dm3 (tlenu) x -------------------------- 11,2 dm3 (tlenu) ------------------------------------------------------x = 78g potasu Zad. 2 W trakcie elektrolizy na elektrodach grafitowych wodnego roztworu NaNO3 wydzieliło się 100,8 dm3 mieszaniny 2-ch gazów (warunki normalne). Oblicz, o ile cm3 zmniejszyła się objętość roztworu (dH2O = 1g/cm3). Rozwiązanie: W trakcie elektrolizy wodnych roztworów soli kwasów tlenowych i metali aktywnych na elektrodach zachodzi elektroliza wody K (-): 2H2O + 2e- H2 + 2OH- 2 2 4 A (+): 2H2O O2 + 4e 4 1 Z równań elektrodowych wynika, że mieszanina gazów stanowi wodór i tlen, które w mieszaninie zajmują objętość w stosunku jak 2 : 1 Obliczenie liczby moli wodoru i tlenu: nH2 = 2/3 ∙ 100,8dm3 : 22,4dm3/mol = 3 mol nO2 = 1/3 ∙ 100,8dm3 : 22,4dm3/mol = 1,5 mol Obliczenie liczby moli i gramów wody 2H2 + O2 2H2O 2mol + 1mol 2 mol 2 mol (wodoru) -------- 2mol (wody) MH2O = 18g/mol 3 mol (wodoru) --------- x 1 mol ---------------- 18g ------------------------------------3 mol ---------------- x x = 3 mole wody ------------------------------x = 54g Obliczenie objętości wody Zad. 3 W dwóch elektrolizerach (I i II) , w których znajdowały się: w I wodny roztwór CuCl2, a w II wodny roztwór AgNO3, przeprowadzono elektrolizę prądem o tym samym natężeniu i tym samym czasie. Po tym czasie w elektrolizerze II wydzieliło się 324 g srebra. a) Zapisz równania reakcji elektrodowych zachodzących w obu elektrolizerach. b) Oblicz liczbę gramów miedzi wydzielonej w I elektrolizerze. c) Oblicz objętość gazów wydzielonych w obu elektrolizerach (warunki normalne). Rozwiązanie: a) Elektrolizer I: CuCl2 ↔ Cu2+ + 2ClElektrolizer II: AgNO3 ↔ Ag+ + NO3 Reakcje elektrodowe: Reakcje elektrodowe: 2+ K (-): Cu + 2e Cu 2 1 K (-): Ag+ +1e- Ag 1 4 2 4 + A (+) 2Cl Cl2 + 2e 2 1 A (+): 2H2O O2 + 4H + 4e 4 1 b) Obliczenie liczby moli miedzi: K (-): Cu2+ + 2e- Cu 2 1 2 + K (-): Ag +1e Ag 1 2 Na 2 mole wydzielonego srebra w II elektrolizerze, w I wydziela się 1 mol miedzi, stąd: 2 ∙ 108g Ag ------------ 1 ∙ 63,5g Cu 3 ∙ 108g Ag ---------- x --------------------------------------x = 95,25 g Cu c) Obliczenie objętości gazów (patrz reakcje elektrodowe w p.pkt a) Elektrolizer I Elektrolizer II 3 63,5 g Cu ---------- 22,4dm Cl2 432 g Ag ------------- 22,4dm3 O2 93,5 g Cu ---------- x 324g Ag -------------- x ------------------------------------------------------------------------------3 x = 33,6 dm chloru x = 16,8 dm3 tlenu Zad. 4. Przez wodny roztwór azotanu(V) bizmutu(III) w elektrolizerze przez 150 minut przepływał prąd stały o natężeniu 5A. Zapisz równania reakcji elektrodowych i oblicz masę/objętość (warunki standardowe) produktów wydzielonych na elektrodach grafitowych w trakcie elektrolizy. Rozwiązanie: Równania elektrodowe: Bi(NO3)3 ↔ Bi3+ + 3NO3 K (-): Bi3+ + 3e- Bi 3 4 12 + A (+): 2H2O O2 + 4H + 4e 4 3 Obliczenie masy wydzielonego bizmutu i objętości wydzielonego tlenu: t = 150min ∙ 60s/min = 9000s; I = 2A = 5C/s; M = 209g/mol, n = 3mol; F = 96480C = bizmutu 4 ∙ 209g Bi --------------- 3 mole O2 32,5g Bi -------------- x -------------------------------------x = 0,1166mol = 0,117mol O2 tlenu Karta pracy IV/1b – Elektroliza : Nazwisko i imię: …………………………………………………… Ocena: ………………………………………. Zad.1 Zapisz równania reakcji elektrodowych w elektrolizerze o elektrodach grafitowych: I. Wodnych roztworów niżej wymienionych elektrolitów oraz określ jakiej zmianie ulega stężenie elektrolitu: a) H2SO4, b) H2S, c) Ca(OH)2, d) KCl, e) Zn(NO3)2 f) FeCl3. II. Elektrolitów stopionych: a) Li2O, b) Ba(OH)2, c) NaCl, d) CuCl2. Zad. 2 W dwóch elektrolizerach (I i II) , w których znajdowały się: w I wodny roztwór CuCl2, a w II wodny roztwór AgNO3, przeprowadzono elektrolizę prądem o tym samym natężeniu i tym samym czasie. Po tym czasie w elektrolizerze I wydzieliło się 3 mole miedzi. a) Zapisz równania reakcji elektrodowych zachodzących w obu elektrolizerach. b) Oblicz liczbę gramów srebra wydzielonego w II elektrolizerze. c) Oblicz objętość gazów wydzielonych w obu elektrolizerach (warunki normalne). Zad.3 Przez wodny roztwór azotanu(V) miedzi(II) w elektrolizerze przez 2,5 godziny przepływał prąd stały o natężeniu 3A. Zapisz równania reakcji elektrodowych i oblicz masę/objętość (warunki normalne) produktów wydzielonych na elektrodach grafitowych w trakcie elektrolizy. Zad.4 W trakcie elektrolizy stopionego Na2O na jednej z elektrod wydzieliło się 11,2dm3 bezbarwnego i bezwonnego gazu ( objętość mierzona w warunkach normalnych). Zapisz równania elektrodowe w elektrolizerze oraz oblicz, ile gramów sodu wydzieliło się na drugiej elektrodzie. Zad.5 W trakcie elektrolizy na elektrodach grafitowych wodnego roztworu HNO3 wydzieliło się 67,2 dm3 mieszaniny 2-ch gazów (warunki normalne). Oblicz, o ile cm3 zmniejszyła się objętość roztworu (dH2O = 1g/cm3). Zad.6 Oblicz, ile minut musi być prowadzona elektroliza wodnego roztworu chlorku chromu(III) przy natężeniu prądu 2,5A, aby wydzielić z roztworu całkowicie 3,01 ∙ 1022 kationów Cr3+ . Rozwiązania: