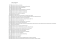Parapneumoniczny wysięk opłucnowy
Transkrypt
Parapneumoniczny wysięk opłucnowy
ARTYKUŁY POGLĄDOWE Parapneumoniczny wysięk opłucnowy Trudności w podejmowaniu decyzji terapeutycznych Parapneumonic pleural effusion: difficulties in making therapeutic decisions Aleksandra Chudzicka, Andrzej Chciałowski Klinika Chorób Wewnętrznych, Pneumonologii i Alergologii, Wojskowy Instytut Medyczny, Warszawa Streszczenie: Zapalenia płuc stanowią drugą pod względem częstości występowania przyczynę wysięków opłucnowych. Pojawienie się płynu w opłucnej pogarsza rokowanie u chorych na zapalenie płuc i przyczynia się do zwiększenia ich śmiertelności, dlatego tak ważne jest możliwie jak najszybsze zastosowanie właściwego leczenia. W większości przypadków wysięk parapneumoniczny wchłania się po zastosowaniu odpowiedniego antybiotyku, niekiedy jednak potrzebne jest bardziej inwazyjne leczenie. Przy podejmowaniu decyzji terapeutycznych wykorzystuje się różne kryteria. Przez wiele lat posługiwano się określeniem charakterystyki biochemicznej płynu, obecnie ocenia się przydatność nowych parametrów. Ich wprowadzenie do diagnostyki stało się możliwe dzięki lepszemu poznaniu mechanizmów uczestniczących w tworzeniu wysięku parapneumonicznego. Słowa kluczowe: drenaż opłucnej, kryteria biochemiczne, parapneumoniczny wysięk opłucnowy Abstract: Pneumonia is the second most common cause of pleural effusion. The presence of pleural fluid makes the prognosis in patients with pneumonia worse and causes a higher mortality rate. This is why it is very important to undertake suitable treatment as soon as possible. Most parapneumonic pleural effusions resolve with antibiotic alone, but sometimes more invasive treatment is necessary. Therapeutic decisions are based on different criteria. For many years determining biochemical fluid characteristics has been used for this purpose. Presentlythe usefullness of new parameters is being evaluated. Their application in diagnostics was possible thanks to better knowledge of mechanisms that participate in the development of parapneumonic pleural effusion. Key words: biochemical criteria, parapneumonic pleural effusion, pleural drainage Parapneumoniczny wysięk opłucnowy to płyn towarzyszący zapaleniu płuc lub innym zakażeniom miąższu płucnego. Roczna zapadalność na zapalenia płuc wynosi 5–11 przypadków na 1000 osób, z czego około 20% wymaga hospitalizacji [1]. Ze względu na dużą częstość występowania zapalenia płuc stanowią drugą pod względem częstości występowania (po nowotworach) przyczynę wysięków opłucnowych [2,3]. Płyn w jamie opłucnej stwierdza się u około 30% chorych na bakteryjne zapalenia płuc [4-6]. Odsetek ten jest jeszcze większy (nawet 75%) w przypadkach, w których konieczna jest hospitalizacja [7,8]. Pojawienie się płynu pogarsza rokowanie i przyczynia się do zwiększenia śmiertelności, dlatego istotne jest możliwie jak Adres do korespondencji: lek. Aleksandra Chudzicka, Klinika Chorób Wewnętrznych, Pneumonologii i Alergologii, Wojskowy Instytut Medyczny, ul. Szaserów 128, 00-909 Warszawa, tel.: 022-681-67-11, fax: 022-681-65-88, e-mail: [email protected] Praca wpłynęła: 16.02.2007. Przyjęta do druku: 22.03.2007. Nie zgłoszono sprzeczności interesów. Pol Arch Med Wewn. 2007; 117 (1-2): 44-48 Copyright by Medycyna Praktyczna, Kraków 2007 44 najszybsze zastosowanie odpowiedniego postępowania, zmierzającego do usunięcia płynu. Większość wysięków parapneumonicznych wchłania się po zastosowaniu antybiotykoterapii. Jednak w około 10% przypadków konieczne jest bardziej inwazyjne leczenie, które obejmuje drenaż opłucnej, a niekiedy także zabiegi torakoskopowe [4,6]. Opóźnienie zastosowania właściwego leczenia jest jedną z głównych przyczyn zwiększonej śmiertelności oraz częstszego występowania powikłań, takich jak tworzenie przegród łącznotkankowych dzielących płyn na zbiorniki czy pogrubienie opłucnej. Dlatego konieczne jest ustalenie kryteriów, które pozwolą możliwie szybko podjąć właściwe decyzje terapeutyczne [8]. Niektóre z nich zostały wprowadzone już przed laty i są nadal wykorzystywane w praktyce klinicznej, jednak ze względu na ich stosunkowo małą czułość i swoistość prowadzone są badania przydatności nowych markerów w diagnostyce różnicowej. POLSKIE ARCHIWUM MEDYCYNY WEWNĘTRZNEJ 2007; 117 (1-2) ARTYKUŁY POGLĄDOWE Patogeneza parapneumonicznego płynu w opłucnej Płyn parapneumoniczny ma charakter wysięku. Powstaje w wyniku bezpośredniego uszkodzenia opłucnej w przebiegu toczącego się procesu zapalnego i zaburzenia funkcji bariery utworzonej przez komórki mezotelium [5,9]. Ekspozycja tych komórek na lipopolisacharyd, trombinę i bakterie prowadzi do zmian przepuszczalności naczyń opłucnej ściennej, gromadzenia się w jamie opłucnej płynu bogatego w białka i rekrutacji komórek zapalnych. W procesie tym uczestniczy śródbłonkowo-naczyniowy czynnik wzrostu (vascular endothelial growth factor – VEGF), uwalniany z komórek mezotelium w wyniku kontaktu z cytokinami i bakteriami [9]. W ostrej fazie dochodzi do napływu neutrofilów, a następnie fagocytów jednojądrzastych oraz limfocytów T, pobudzanych wtórnie do aktywacji komórek mezotelium. Te ostatnie uczestniczą w przenikaniu komórek efektorowych do przestrzeni opłucnowej. W procesie tym zasadniczą rolę odgrywają cząsteczki adhezyjne [5]. Na powierzchni komórek mezotelium obecna jest cząsteczka przylegania międzykomórkowego ICAM-1 (intercellular adhesion molecule-1), która pod wpływem cytokin prozapalnych, takich jak czynnik martwicy nowotworów alfa (tumor necrosis factor α – TNF-α) czy interferon gamma (IFNγ), oddziałuje z integryną CD11/CD18 (lymphocyte function antygen-1 – LFA-1), zlokalizowaną na powierzchni komórek fagocytarnych, co tym samym umożliwia przyleganie neutrofilów i monocytów do mezotelium oraz ich następowe przenikanie do jamy opłucnej [9]. W toczącym się procesie zapalnym uczestniczy wiele cytokin. Jedną z nich jest interleukina 8 (IL-8), należąca do rodziny chemokin [9-12], wydzielana przez różne komórki, w tym śródbłonek naczyń, komórki nabłonkowe, mezangialne, owodniowe, neutrofile, limfocyty T i fagocyty jednojądrzaste. W przestrzeni opłucnowej obecne są tylko niektóre z nich. Dotychczas nie wiadomo, które (poza komórkami mezotelium) mogą być odpowiedzialne za syntezę IL-8, odgrywającej kluczową rolę w migracji komórek efektorowych, zwłaszcza neutrofilów, do jamy opłucnej. Duże stężenie IL-8 towarzyszy wysiękowi parapneumonicznemu, a zwłaszcza ropniakowi opłucnej [10]. Inną cytokiną uczestniczącą w miejscowym procesie zapalnym jest TNF-α, wydzielany głównie przez komórki mezotelium oraz makrofagi opłucnowe. Pobudza on chemotaksję neutrofilów, aktywuje komórki zapalne i reguluje ostrą fazę reakcji zapalnej przez nasilenie uwalniania innych cytokin, w tym IL-8. Oddziałuje również na proliferację fibroblastów i komórek mezotelium oraz syntezę kolagenu [9,12]. Jego duże stężenie wykryto w różnych chorobach opłucnej, m.in. w chorobach wywołanych czynnikiem infekcyjnym oraz związanych z nowotworami [12]. Wykazano także znaczący udział tlenku azotu (NO) w indukcji procesu zapalnego w wyniku zwiększenia przepuszczalności naczyń, pobudzenia proliferacji fibroblastów, uwalniania cytokin, m.in. IL-8 i TNF-α, oraz oddziaływania chemotaktycznego w stosunku do monocytów i makrofagów [12]. Parapneumoniczny wysięk opłucnowy W procesie tworzenia parapneumonicznego płynu w opłucnej można wyróżnić 3 nakładające się na siebie fazy [7]: 1) wysiękową 2) włóknikowo-ropną 3) włóknienia. Dlatego też się przyjmuje, że wysięk parapneumoniczny nie jest określeniem stanu, ale dynamicznego procesu przemian zachodzących w jamie opłucnej. Na kolejnych etapach dochodzi do zwiększenia liczby leukocytów i stężenia dehydrogenazy mleczanowej (LDH) oraz do zmniejszenia stężenia glukozy w płynie i jego pH [6,8]. Na wartości tych parametrów wpływa aktywność metaboliczna bakterii oraz komórek zapalnych. Ocenia się, że czas potrzebny do przejścia od pierwszej do ostatniej fazy wynosi 2–3 tygodni [8]. Uwzględniając etapowy przebieg tworzenia płynu parapneumonicznego, podzielono go na 2 grupy: 1) niepowikłany wysięk parapneumoniczny, 2) powikłany wysięk parapneumoniczny [7]. Końcowym stadium zachodzących przemian jest powstanie ropniaka opłucnej, definiowanego jako infekcja jamy opłucnej związana z tworzeniem gęstego płynu ropnego [13]. W miarę postępu ropniaka w przestrzeni opłucnowej następuje włóknienie, mogące doprowadzić do powstania tzw. fibrothorax, czyli utworzenia na powierzchni płuca niepodatnej warstwy włóknika, która z czasem ulega organizacji i powoduje zaburzenia wentylacji o charakterze restrykcyjnym. Mechanizmy powodujące włóknienie w obrębie jamy opłucnej nie zostały do końca poznane. Jednym z czynników, który może odgrywać rolę w tym procesie, jest transformujący czynnik wzrostu β (transforming growth factor β – TGFβ), należący do grupy cytokin. Przyczynia się on do pobudzenia proliferacji fibroblastów i tworzenia macierzy pozakomórkowej, stanowiąc jednocześnie czynnik immunosupresyjny dla limfocytów. Prawidłowe komórki mezotelium syntetyzują i uwalniają TGFβ, mają także receptory dla tej cytokiny, co wskazuje na jej autokrynne działanie w obrębie opłucnej [13]. TGFβ jest białkiem mającym 5 izoform [13]. W procesach włóknienia rolę odgrywa przede wszystkim izoforma TGFβ1, której istotnie zwiększone stężenia wykazano w parapneumonicznym wysięku opłucnowym. Stwierdzono dodatnią korelację jej stężenia ze stężeniem LDH, będącego markerem zapalenia. Sasse i wsp. wykazali, że stężenie TGFβ1 zwiększa się w miarę postępu włóknienia w jamie opłucnej, korelując z liczbą fibroblastów [13]. Przegrody łącznotkankowe dzielące jamę opłucnej na zbiorniki tworzą się w fazie włóknikowo-ropnej i są związane z odkładaniem złogów włóknika [2,14]. Taki stan jest czynnikiem niekorzystnym rokowniczo, utrudniającym skuteczny drenaż opłucnej. Następuje wówczas zwiększenie aktywności prokoagulacyjnej płynu, związanej głównie z działaniem czynników tkankowych [15], zmniejszeniu ulega natomiast aktywność układu fibrynolitycznego, regulowanego przez precyzyjne współdziałanie jego aktywatorów i inhibitorów. U chorych z płynem w jamie opłucnej stwierdzono duże stężenie tkankowego aktywatora plazmiongenu (tissue plasminogen 45 ARTYKUŁY POGLĄDOWE activator – t-PA), urokinazy (urokinase plasminogen activator – u-PA) oraz ich inhibitorów (plasminogen actvation inhibitor – PAI1 i PAI -2) w przestrzeni opłucnowej [3,15]. Jednak procesy fibrynolizy wykazują u tych chorych mniejszą aktywność, co jest wynikiem głównie większej aktywności inhibitorów aktywatora plazminogenu. Aktywność fibrynolityczna osocza jest modulowana przez zapalenie. Przypuszcza się również, że istnieje związek między procesami fibrynolizy w płynie opłucnowym a procesami zapalnymi [15]. Istotną rolę odgrywają tu cytokiny prozapalne, takie jak TNF-α czy interleukina 1 β (IL-1β), które zaburzają równowagę między PAI-1 a t-PA w jamie opłucnej. Rozróżnienie niepowikłanego i powikłanego wysięku parapneumonicznego ma duże znaczenie, wpływa bowiem na decyzje terapeutyczne. Stwierdzenie powikłanego charakteru płynu wskazuje, że zastosowanie wyłącznie antybiotykoterapii może być nieskuteczne i chory może wymagać drenażu jamy opłucnej. Badanie przedstawionych procesów patofizjologicznych i wykrywanie nowych czynników uczestniczących w tworzeniu parapneumonicznego płynu w opłucnej mogą doprowadzić do uzyskania nowych markerów pomocnych w różnicowaniu tych 2 rodzajów płynów, a tym samym stworzyć możliwość szybszego podjęcia skutecznego leczenia. Różnicowanie niepowikłanego i powikłanego wysięku parapneumonicznego Mimo że większość parapneumonicznych płynów w jamie opłucnej wchłania się w wyniku stosowanej antybiotykoterapii, w każdym przypadku wskazane jest wykonanie torakocentezy. Uzyskany materiał poddawany jest następnie analizie fizycznej (wygląd i zabarwienie), immunobiochemicznej oraz mikrobiologicznej. Sam wygląd płynu niejednokrotnie pozwala na podjęcie decyzji terapeutycznych. Jego ropny charakter przemawia za ropniakiem opłucnej i koniecznością wykonania drenażu opłucnej [3]. Podobne postępowanie wskazane jest w przypadku dodatniego wyniku badania mikrobiologicznego, aczkolwiek niektóre obserwacje i analizy wskazują, że około 10% chorych z dodatnim wynikiem posiewu dobrze reaguje na antybiotykoterapię. Drenaż jest niekiedy konieczny również w tych przypadkach, gdy nie stwierdza się ropnego charakteru płynu, czyli u chorych z grupy z tzw. powikłanym płynem parapneumonicznym. Wyodrębnienie chorych z tej grupy stanowi duże wyzwanie dla klinicystów [6]. W praktyce klinicznej w rozpoznawaniu powikłanego płynu w opłucnej stosuje się kryteria biochemiczne. Według zaleceń American College of Chest Physicians oraz British Thoracic Society stwierdzenie pH płynu <7,2 oraz małego (<60 mg/dl) stężenia glukozy wiąże się ze złym rokowaniem i stanowi wskazanie do bardziej agresywnej terapii [16,17]. Light dołączył do tych kryteriów jeszcze duże (>1000 U/l) stężenie LDH [18]. Parametry biochemiczne płynu zmieniają się w zależności od czasu trwania i ciężkości infekcji płucnej oraz od odpowie46 dzi zapalnej gospodarza [7]. Na początkowym etapie w płynie stwierdza się duże stężenie białka, co odzwierciedla jego filtrację do jamy opłucnej w wyniku zwiększonej przepuszczalności naczyń. Zwiększone zaś stężenie LDH wynika z jego miejscowego uwalniania z komórek. Stężenie glukozy w prawidłowych warunkach stanowi odzwierciedlenie jej stężenia w surowicy, natomiast w przebiegu procesu zapalnego nasilony metabolizm komórek efektorowych i bakterii przyczynia się do nadmiernego zużycia glukozy i uwalniania kwasu mlekowego oraz dwutlenku węgla, przyczyniających się do zmniejszenia pH. Pomiar pH płynu, oprócz oceny wyglądu makroskopowego, był jednym z pierwszych badań pozwalających na różnicowanie jego niepowikłanego i powikłanego charakteru, stwierdzenie kwaśnego odczynu płynu jest bowiem wskazaniem do zastosowania drenażu opłucnej. Należy pamiętać, że do zmniejszenia pH dochodzi dopiero w zaawansowanej fazie infekcji, a nieprawidłowy sposób pobrania materiału oraz opóźnienie w wykonaniu jego analizy mogą dodatkowo wpływać na wyniki oznaczania równowagi kwasowo-zasadowej [7]. Dlatego też konieczne jest pozyskanie płynu w warunkach ściśle beztlenowych, a także jak najszybsza jego analiza, aczkolwiek w codziennej praktyce warunki te nie zawsze mogą być spełnione. Istnieją również sytuacje, w których ocena pH ma wątpliwą wartość przy podejmowaniu decyzji terapeutycznych [7]. Pierwszą z nich jest stwierdzenie pH 7,0–7,2. Trudno wówczas jednoznacznie stwierdzić, czy powinno się zastosować jedynie antybiotykoterapię, czy też drenaż. Kolejne sytuacje, w których pomiar pH staje się mało wiarygodny, to wspomniane wcześniej trudności techniczne w pozyskiwaniu, transporcie i analizie próbki oraz wcześniejsze zastosowanie antybiotyku. Kolejne metody różnicowania charakteru płynu to określanie stężenia glukozy i LDH. Przeprowadzona metaanaliza wykazała, że spośród wszystkich wymienionych markerów biochemicznych największą wartość różnicującą ma pomiar pH płynu, który pozwala lepiej niż określenie stężenia glukozy i LDH wydzielić grupę chorych wymagających drenażu opłucnej [19]. Parametry te mogą również ułatwić rozpoznawanie tych przypadków, w których mogą wystąpić powikłania w postaci tworzenia zbiorników lub pogrubienia opłucnej. U chorych z tendencją do tworzenia zbiorników Himelman i Callen stwierdzili znacząco mniejsze pH i stężenie glukozy, a większe stężenie LDH oraz objętość płynu niż u chorych z wolnym płynem w jamie opłucnej [20]. Podobne wyniki przedstawili Chung i wsp. [15]. Maskell i wsp. ujawnili, że w przypadku wytworzenia w jamie opłucnej zbiorników poprzedzielanych przegrodami łącznotkankowymi pH może być różne w poszczególnych przestrzeniach [2]. Główne czynniki powodujące redukcję pH w jamie opłucnej to leukocyty oraz bakterie, metabolizujące glukozę do kwasu mlekowego oraz dwutlenku węgla, gazu łatwo dyfundującego i ulegającego równomiernej dystrybucji w przestrzeni opłucnowej. Dwutlenek węgla nie może się więc przyczyniać do powstania różnic w pH w poszczególnych POLSKIE ARCHIWUM MEDYCYNY WEWNĘTRZNEJ 2007; 117 (1-2) ARTYKUŁY POGLĄDOWE zbiornikach, dlatego się uważa, że różnice te wynikają raczej ze zmiennego stężenia kwasu mlekowego i innych rozpuszczalnych kwasów. Wyniki te wskazują, że w przypadku wytworzenia się zbiorników należy zachować ostrożność przy podejmowaniu decyzji terapeutycznych. Jeżeli u chorego, u którego prawdopodobieństwo powikłanego płynu jest duże, w pierwszym badaniu stwierdza się zaskakująco duże pH, należy przeprowadzić kolejne pomiary. Dobrze jest również wykonać dokładną ocenę ultrasonograficzną jamy opłucnej, która pozwoli na uwidocznienie przegród i dokładną lokalizację poszczególnych zbiorników. Nowe parametry wykorzystywane przy podejmowaniu decyzji terapeutycznych Stosowane dotychczas kryteria różnicujące niepowikłany i powikłany wysięk parapneumoniczny nie są w pełni precyzyjne i cechują się niewystarczającą swoistością, dlatego poszukuje się nowych markerów umożliwiających rozpoznanie tych rodzajów płynów. Jak już wspomniano, w procesach patofizjologicznych zachodzących podczas tworzenia płynu uczestniczą różne cytokiny prozapalne, dlatego zaczęto oceniać przydatność pomiaru ich stężenia w podejmowaniu decyzji terapeutycznych. W płynie parapneumonicznym wykryto duże stężenia IL-8 [9,10]. Stwierdzono, że jest ono zdecydowanie większe w ropniaku opłucnej niż w niepowikłanym wysięku. Ropniak opłucnej to płyn, w którym panują specyficzne warunki. Jego kwaśny odczyn i stosunkowo duża aktywność enzymów proteolitycznych sprawiają, że wiele białek ulega w nim szybkiemu rozkładowi. Wydaje się, że IL-8 jest odporna na inaktywację i tym samym może dłużej utrzymać swą aktywność [10]. Dowodzą tego badania Utine i wsp., przeprowadzone w grupie dzieci z wysiękiem parapneumonicznym, potwierdzające przydatność IL-8 jako markera w różnicowaniu niepowikłanego i powikłanego charakteru płynu [12]. W odpowiedzi zapalnej kluczową rolę odgrywa także TNFα. Istnieją doniesienia wskazujące, że może ułatwiać identyfikację chorych z powikłanym płynem w jamie opłucnej [6]. Odeh i wsp. wykazali jego większe stężenia w tej grupie wysięków w porównaniu z płynami o charakterze niepowikłanym [21]. Porcel i wsp. zaś uznali TNF-α za dobry wykładnik zapalenia u chorych z płynem w opłucnej, stwierdzając jego większą czułość diagnostyczną w porównaniu z określeniem pH i stężenia glukozy [6]. Połączenie oznaczenia stężenia TNF-α i stężenia LDH jeszcze bardziej zwiększało tę czułość. Przedstawione dane jednoznacznie wskazują, że zwiększone stężenie TNF-α umożliwia dokładniejszą niż tradycyjne kryteria biochemiczne identyfikację grupy chorych z nieropnym płynem, wymagających drenażu jamy opłucnej. Wspomniany wcześniej Utine porównał przydatność pomiaru stężenia obu cytokin w różnicowaniu niepowikłanych i powikłanych wysięków parapneumonicznych, wykazując zdecydowanie większą czułość, swoistość i dokładność IL-8 w stosunku do TNF-α [12]. Parapneumoniczny wysięk opłucnowy Pomiary stężeń cytokin mogą mieć też duże znaczenie w identyfikacji chorych, u których mogą wystąpić powikłania pod postacią tworzenia się przegród łącznotkankowych i podziału przestrzeni płynowej na zbiorniki. Jak już wspomniano, powstawanie przegród związane jest z odkładaniem włóknika w obrębie jamy opłucnej. W procesie tym istotną rolę odgrywają zarówno TNF-α, jak i IL-1β, które zaburzają równowagę pomiędzy procesami tworzenia i rozkładu włóknika. Pewne znaczenie może mieć dodatkowo TGFβ, pobudzający włóknienie [15]. Chung i wsp. stwierdzili różnice w regulacji procesów fibrynolizy u chorych z wolnym płynem w jamie opłucnej i tych z późniejszym tworzeniem zbiorników [15]. Różnica ta może wynikać z różnej aktywności cytokin prozapalnych oraz TGFβ. Ujawniono większe stężenia TNF-α, IL-1β, TGFβ1 oraz PAI-1 w płynie u chorych z tendencją do tworzenia zbiorników w porównaniu z płynem wolnym. Poszukując kolejnych markerów różnicujących niepowikłane i powikłane płyny parapneumoniczne, Alegre i wsp. ocenili przydatność w tej diagnostyce mieloperoksydazy (MPO) – enzymu proteolitycznego uwalnianego w ostrej fazie reakcji zapalnej z ziarnistości kwasochłonnych neutrofilów [7]. Rolę MPO jako markera reakcji zapalnej wykorzystywano w rozpoznawaniu zapalenia ucha środkowego, przewlekłego zapalenia zatok obocznych nosa, przewlekłego zapalenia oskrzeli lub zapalenia otrzewnej o etiologii bakteryjnej. W przypadkach tych stwierdzono korelację między jej aktywnością a stężeniem IL-8. U chorych z powikłanym płynem parapneumonicznym stwierdzono większe stężenia MPO niż u chorych z płynem niepowikłanym [7]. Wykryto ponadto istotną korelację pomiędzy jej stężeniem a stężeniami standardowo używanych markerów różnicujących. Oznaczanie aktywności tego enzymu może mieć szczególne znaczenie w przypadkach trudnych do rozstrzygnięcia na podstawie klasycznych parametrów. W toku dalszych badań oceniono przydatność innych enzymów proteolitycznych (proteaz) rozkładających macierz pozakomórkową [14]. Należą do nich są metaloproteinazy (MMP), które przyczyniają się do rozkładu niemal wszystkich składników macierzy pozakomórkowej. Dotychczas opisano kilka ich podgrup; w zależności od struktury i swoistości substratowej są to: 1) kolagenazy (MMP-1, MMP-8) 2) żelatynazy (MMP-2, MMP-9) 3) stromelizyny 4) metaloproteinazy przezbłonowe. Ich aktywność jest kontrolowana i modulowana poprzez specyficzne inhibitory tkankowe (tissue metaloproteinase inhibitor – TIMP). W przebiegu różnych procesów chorobowych dochodzi do zaburzenia równowagi między MMP a ich naturalnymi inhibitorami. Iglesias i wsp. wykazali bardzo duże stężenia MMP-1, MMP-9, a zwłaszcza MMP-8, u chorych z ropniakiem opłucnej i powikłanym parapneumonicznym wysiękiem opłucnowym [14]. Zwiększone stężenie MMP-1 może być związane z jej uwalnianiem przez komórki mezotelium po pobudzeniu przez mediatory zapalne. Natomiast zwiększenie stężenia MMP-8 i MMP-9 wynika ze wzmożonej aktywności granu47 ARTYKUŁY POGLĄDOWE parapneumoniczny wysięk opłucnowy dotychczasowe kryteria wygląd ropny posiew dodatni pH <7,2 glukoza <60 mg/dl LDH >1000 U/I nowe kryteria IL-8 TNF-α IL-1β TGFβ MPO MMP-1, -8, -9 drenaż locytów obojętnochłonnych. Wykazano istotną korelację stężenia MMP z innymi markerami zapalenia, zwłaszcza IL-8 i TNF-α, które odpowiadają za pobudzenie, chemotaksję i degranulację neutrofilów w przestrzeni opłucnowej, co wskazuje na znaczącą rolę tych enzymów w rozwoju późnych powikłań opłucnowych [14]. PODSUMOWANIE Określenie „parapneumoniczny wysięk opłucnowy” oznacza dynamiczny proces przemian, jakie zachodzą w jamie opłucnej w wyniku zadziałania czynnika infekcyjnego. Na poszczególnych etapach zmieniają się właściwości fizykochemiczne i immunologiczne płynu gromadzącego się w przestrzeni opłucnowej. Zastosowane leczenie znacząco wpływa na odpowiedź kliniczną. We wczesnych fazach tworzenia płynu do jego resorpcji dochodzi już w wyniku właściwie stosowanej antybiotykoterapii. Na kolejnych etapach takie postępowanie może być niewystarczające i konieczne staje się stosowanie bardziej inwazyjnych metod leczniczych, takich jak: 1) drenaż opłucnej lub 2) techniki torakochirurgiczne. W procesie podejmowania decyzji terapeutycznych ważną rolę odgrywa oznaczenie biochemicznych wyznaczników zapalnych płynu opłucnowego. Na podstawie tych oznaczeń przez wiele lat ustalano wskazania do drenażu opłucnej. Nie stanowią one jednak kryteriów w pełni precyzyjnych, dlatego wciąż poszukuje się nowych markerów przydatnych w różnicowaniu charakteru płynu (ryc.). Badania nad patogenezą płynów oraz określanie stężenia cytokin pozapalnych oraz uwalnianych w nadmiarze enzymów (uczestniczących w procesie jego tworzenia) mogą stanowić nowe wyznaczniki w wyodrębnieniu chorych wymagających skutecznego leczenia w postaci drenażu opłucnej. Konieczne są jednak dalsze badania nad określaniem czułości i swoistości tych markerów. 48 Ryc. Dotychczasowe i nowe kryteria kwalifikujące parapneumoniczny płyn w opłucnej do drenażu. Skróty: IL – interleukina, MMP – metaloproteinazy, MPO – mieloperoksydaza, LDH – dehydrogenaza mleczanowa, TGFβ – transformujący czynnik wzrostu β, TNF-α – czynnik martwicy nowotworów α PIŚMIENNICTWO 1. Wytyczne British Thoracic Society. Postępowanie w pozaszpitalnym zapaleniu płuc u dorosłych – część II. Med Prakt. 2002; 11: 99-144. 2. Maskell NA, Gleeson FV, Darby M, et al. Diagnostically significant variations in pleural fluid pH in loculated parapneumonic effusions. Chest 2004; 126: 20222024. 3. Philip-Joët F, Alessi M-C, Philip-Joët C, et al. Fibrynolitic and inflammatory processes in pleural effusions. Eur Respir J. 1995; 8: 1352-1356. 4. Davies CWH, Kearney SE, Gleeson FV, et al. Predictors of outcome and long-term survival in patients with pleural infection. Am J Respir Crit Care Med. 1999; 160: 1682-1687. 5. Kroegel C, Antony VB. Immunobiology of pleural inflammation: potential implications for pathogenesis, diagnosis and therapy. Eur Respir J. 1997; 10: 2411-2418. 6. Porcel JM, Vives M, Esquerda A. Tumor necrosis factor-α in pleural fluid. A marker of complicated parapneumonic effusions. Chest 2004; 125: 160-164. 7. Alegre J, Jufresa J, Segura R, et al. Pleural-fluid myeloperoxidase in complicated and noncomplicated parapneumonic pleural effusions. Eur Respir J. 2002; 19: 320325. 8. Castro DJ, Diaz G, Pérez-Rodriguez E, et al. Prognostic features of residual pleural thickening in parapneumonic pleural effusions. Eur Respir J. 2003; 21: 952-955. 9. Antony VB. Immunological mechanisms in pleural disease. Eur Respir J. 2003; 21: 539-544. 10. Broaddus VC, Hébert CA, Vitangcol RV, et al. Interleukin-8 is a major neutrophil chemotactic factor in pleural liquid of parients with empyema. Am Rev Respir Dis. 1992; 146: 825-830. 11. Pace E, Gjomarkaj M, Melis M, et al. Interleukin-8 induces lymphocyte chemotaxis into the pleural space. Am J Respir Crit Care Med. 1999; 159: 1592-1599. 12. Utine GE, Ozeelik U, Yalcin E, et al. Childhood parapneumonic effusions: biochemical and inflammatory markers. Chest 2005; 128: 1436-1441. 13. Sasse SA, Jadus MR, Kukes GD. Pleural fluid transforming growth factor-β1 correlates with pleural fibrosis in experimental empyema. Am J Respir Crit Care Med. 2003; 168: 700-705. 14. Iglesias D, Alegre J, Alemán C, et al. Metalloproteinases and tissue inhibitors of metalloproteinases in exudative pleural effusions. Eur Respir J. 2005; 25: 104-109. 15. Chung CL, Chen CH, Sheu JR, et al. Proinflammatory cytokines, transforming growth factor-β1, and fibrynolitic enzymes in loculated and free-flowing pleural exudates. Chest 2005; 128: 690-697. 16. British guideline on the management of pleural diseases. Thorax 2003; 58 (suppl): 1-52. 17. Colice GL, Curtis A, Deslauriers J, et al. Medical and surgical treatment of parapneumonic effusions: an evidence-based guideline. Chest 2000; 118: 4-71. 18. Light RW. A new classification of parapneumonic effusions and empyema. Chest 1995; 108: 299-301. 19. Heffner JE, Brown LK, Barberi C, et al. Pleural fluid chemical analysis in parapneumonic effusions: a meta-analysis. Am J Repir Crit Care Med. 1995; 151: 1700-1708. 20. Himelman RB, Callen CW, et al. The prognostic value of loculation in parapenumonic pleural effusions. Chest 1986; 90: 852-856. 21. Odeh M, Sabo E, Oliven A, et al. Role of tumor necrosis factor-α in the differential diagnosis of parapneumonic effusion. Int J Infect Dis. 1999;4:38-41. POLSKIE ARCHIWUM MEDYCYNY WEWNĘTRZNEJ 2007; 117 (1-2)