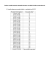politechnika gdańska - Katedra Technologii Chemicznej
Transkrypt
politechnika gdańska - Katedra Technologii Chemicznej
POLITECHNIKA GDAŃSKA WYDZIAŁ CHEMICZNY KATEDRA TECHNOLOGII CHEMICZNEJ CHEMIA ŚRODOWISKA BADANIE PARAMETRÓW FIZYKOCHEMICZNYCH ŚCIEKÓW Gdańsk 2010 CZĘŚĆ TEORETYCZNA 1. Woda i ścieki Zanieczyszczeniem wody jest dodatek jakiejkolwiek substancji lub energii, która pośrednio lub bezpośrednio zmienia stan zbiornika wodnego w taki sposób, który negatywnie wpływa na jego planowane wykorzystanie. Zanieczyszczenia wody możemy podzielić na punktowe – kiedy zanieczyszczenia przedostają się do wody z punktów o określonym położeniu w przestrzeni (jak np. gospodarstwa domowe, zakłady przemysłowe itp.) lub rozproszone – kiedy zanieczyszczenia przedostają się do wody z dużych obszarów, należą do nich głównie spływy powierzchniowe. Ścieki są to wody zużyte na cele gospodarczo-bytowe lub przemysłowe. Należą do nich odpływy z − gospodarstw domowych − instytucji użyteczności publicznej (szkoły, szpitale itp.) − zakładów przemysłowych − spływy powierzchniowe (pochodzące głównie z opadów atmosferycznych) W wielu krajach rozwiniętych spływy powierzchniowe z kanałów burzowych posiadające niewielki ładunek zanieczyszczeń są transportowane oddzielnymi systemami kanałów i są oczyszczane odrębnie. Do oczyszczalni ścieków trafiają głównie ścieki gospodarczo-bytowe. Rozcieńczanie tych ścieków wodami opadowymi jest w wielu krajach zabronione. W pozostałych krajach stosowany jest system jednoczesnego oczyszczania ścieków i wód opadowych, w tym przypadku oczyszczalnie ścieków muszą posiadać znacznie większą przepustowość. Około 99% ścieków stanowi woda. Pozostały 1% to substancje stałe zawieszone lub rozpuszczone. Ścieki stanowią układ wielofazowy złożony z: − ciał stałych pływających − zawiesin łatwo opadających, − zawiesin trudno opadających, − koloidów o wymiarach, − substancji rozpuszczonych Substancje nie rozpuszczone składające się z substancji pływających i zawieszonych w wodzie nazywane są zawiesinami. Mogą one być pochodzenia naturalnego, np. cząstki grobnego piasku, gliny, wytrącone związki żelaza i manganu, organizmy wodne lub antropogenicznego jak zanieczyszczenia wód ściekami miejskimi lub przemysłowymi złożone z resztek żywności, środków higieny osobistej, detergentów, pestycydów, olejów i innych związków chemicznych pochodzenia przemysłowego itp. Wody podziemne są na ogół wolne od zawiesin , podczas gdy wody powierzchniowe mogą zawierać znaczne ich ilości. Przed wytypowaniem metody oczyszczania ścieków prowadzi się wstępne badania, dostarczające informacji na temat formy występowania zanieczyszczeń. Możliwe formy występowania zanieczyszczeń w odciekach i odpowiadające im sposoby separacji zamieszczono w Tabeli 1. Tabela 1. Forma występowania zanieczyszczeń w odciekach i metody ich usuwania Zanieczyszczenie Zawiesiny łatwo opadające Zawiesiny trudno opadające Sposób seperacji Sedymentacja Filtracja na przegrodzie lub filtracja wgłębna Odpad Piasek, osad Placek filtracyjny lub zagęszczona zawiesina Zanieczyszczenia koloidalne Koagulacja oraz metoda biologiczna Związki rozpuszczone Metoda biologiczna, wytrącanie chemiczne (np. fosforanów) Osad koagulacyjny i/lub osad czynny nadmierny Osad czynny nadmierny i/lub precypitat Usuwanie zawiesin należy do mechanicznych sposobów oczyszczania wody i ścieków. W tym celu wykorzystywane są kraty, sita, piaskowniki i osadniki. Do usuwania ciał stałych pływających wykorzystywane są kraty i sita, zawiesiny łatwoopadające usuwane są za pomocą osadników a zawiesiny trudnoopadające za pomocą filtrów. Mętność to optyczna właściwość drobnych zawiesin do rozpraszania światła. Powodowana jest przez obecność drobnych zawiesin lub koloidów pochodzenia organicznego lub nieorganicznego (glina, ił, wytrącające się związki żelaza, manganu i glinu, substancje humusowe). Mętność wody oznacza się przez porównanie z wzorcami zawierającymi zawiesiny krzemionki (SiO2). Jako jednostkę mętności przyjmuje się mętność wywołaną przez 1 mg zawiesiny wzorcowej krzemionki dodanej do 1 dm3 wody destylowanej. Nie należy utożsamiać zawiesin z mętnością, która jest zjawiskiem optycznym i zależy głównie od stopnia ich dyspersji. Ze względu na rozmaity skład zawiesin i różną ich masę właściwą mętność ścieków nie jest równoważna wagowej ilości zawiesin. 2. Sedymentacja Na cząstki stałe w cieczy działają siły ciężkości, wyporu oraz oporu ośrodka. Wypadkowa tych sił nadaje ruch cząstkom stałym. Jeżeli siła wypadkowa jest zgodna z siłą ciężkości, cząstka opada i mamy wówczas do czynienia z procesem sedymentacji. Proces ten dotyczy cząstek o wyższym ciężarze właściwym niż ciecz. Woda, ścieki, odcieki ze składowisk poza substancjami rozpuszczonymi, mogą zawierać również substancje pływające oraz zawieszone, zarówno mineralne (piasek, glina itp.), jak i organiczne. Są to tzw. zawiesiny, które można podzielić na: - zawiesiny mineralne (nielotne), - zawiesiny lotne, - zawiesiny ogólne (suma zawiesin lotnych i mineralnych). Sedymentacja jest jednym z podstawowych procesów pozwalających na ocenę ilości zanieczyszczeń występujących w postaci zanieczyszczeń łatwo opadających wydzielających się w ciągu określonego czasu odstania. W zależności od charakteru i ilości zawiesin wyróżnia się: - opadanie cząstek ziarnistych, - opadanie cząstek kłaczkowatych, - sedymentację strefową. Sedymentacja cząstek ziarnistych zależy od kształtu, wielkości i gęstości ziaren, wzajemnego oddziaływania, jak również oporu ośrodka i charakteru opadania cząstek (ruch laminarny, burzliwy) w ośrodku. Cząstki kłaczkowate występują w ściekach surowych o zawartości zawiesin poniżej 500 mg/dm3 oraz w ściekach po koagulacji i chemicznym strącaniu. Szybkość opadania tych cząstek wzrasta z głębokością osadnika, a tory ruchu cząstek są krzywymi w odróżnieniu od prostoliniowych torów cząstek ziarnistych. Sedymentacja strefowa zachodzi, gdy zawartość zawiesin kłaczkowatych przekracza 1000 mg/dm3, lub gdy zawiesina niekłaczkująca występuje w znacznych ilościach. W tym rodzaju sedymentacji na skutek znacznego zagęszczenia cząstek występuje wzajemne oddziaływanie (zderzanie się) cząstek, w wyniku którego tworzą się aglomeraty. W takich warunkach cząstki opadają w postaci „chmury” lub „warstwy osadu”, a oprócz sedymentacji występuje zjawisko zagęszczania osadu. Pod względem właściwości fizycznych zawiesiny dzieli się na : - zawiesiny łatwo opadające, czyli te które opadną w określonym czasie pozostawania w leju Imhoffa, - zawiesiny trudno opadające, które stanowią różnicę między ogólną ilością zawiesin a ilością zawiesin łatwo opadających. 3. Koagulacja Koagulacja pozwala na wydzielenie zanieczyszczeń występujących w postaci koloidów oraz zawiesin trudno opadających. Istotą procesu jest zmniejszenie stopnia dyspersji układu koloidalnego w wyniku łączenia się pojedynczych cząstek fazy rozproszonej w większe skupiska (aglomeraty), które można usunąć z oczyszczanej wody na drodze sedymentacji, flotacji lub filtracji. Właściwie przebiegająca koagulacja zapewnia nie tylko duży stopień usuwania koloidów i zawiesin trudnoopadajacych, ale również zasocjowanych z nimi innych zanieczyszczeń. Efektem skutecznej koagulacji jest zmniejszenie mętności, intensywności barwy zanieczyszczeń organicznych, oraz wielu mikrozanieczyszczeń zawartych w wodzie oczyszczanej w postaci form trudno rozpuszczalnych lub agregatów. Koagulację prowadzi się za pomocą koagulantów, które w wodzie ulegają hydrolizie a produkty ich hydrolizy powodują koagulację elektrolitem oraz koagulację koloidem o znaku przeciwnym w stosunku do koloidów usuwanych. Do najczęściej stosowanych w oczyszczaniu wody koagulantów należą sole glinu i żelaza tworzące w wyniku hydrolizy dodatnio naładowane połączenia (hydrokompleksy) skutecznie destabilizujące obecne w oczyszczanej wodzie koloidy. Do związków tych należą: - siarczan glinowy Al2(SO4)3 · 18 H2O, (pH 5,5 – 7,5); - siarczan żelazowy Fe2(SO4)3 · 9 H2O, (pH 5 – 7 i 9,0 – 9,6); - siarczan żelazawy FeSO4 · 7 H2O, (pH 9 – 11) - chlorek żelazowy FeCl3 · 6 H2O, (pH 5 – 7 i > 8,5). Przebieg dysocjacji i hydrolizy siarczanu glinowego, która ze względu na ich wielowartościowość przebiega wieloetapowo przedstawiają poniższe reakcje: Al2(SO4)3 → 2Al+3 + 3SO4-2 (dysocjacja) +3 2Al + 2 H2O ↔ 2Al(OH)+2 +2H+ (I stopień hydrolizy) 2Al(OH)+2 + 2 H2O ↔ 2Al(OH)2+ + 2H+ (II stopień hydrolizy) 2Al(OH)2+ + 2 H2O ↔ 2Al(OH)3 + 2H+ (III stopień hydrolizy) Al2(SO4)3 + 6 H2O ↔ 2Al(OH)3+ 6H+ + 3SO4-2 Do najtańszych koagulantów zaliczane są siarczany żelaza II i żelaza III. Są one odporne na niską temperaturę oraz mogą być stosowane w szerokim zakresie pH. Powstające w czasie koagulacji solami żelaza (hydrolizują analogicznie do siarczanu glinu) kłaczki są ciężkie i dobrze sedymentują. Przebieg procesu koagulacji można podzielić na dwa etapy: - etap destabilizacji układu koloidalnego, - etap flokulacji. Po dodaniu koagulanta do oczyszczanej wody następuje faza destabilizacji cząstek koloidalnych w wyniku reakcji chemicznych i fizycznych. Po fazie destabilizacji następuje trwająca znacznie dłużej faza tzw. flokulacji, w czasie której w wyniku transportu i zderzeń zdestabilizowanych cząstek powstają kłaczki skutecznie usuwane z wody na drodze sedymentacji oraz filtracji. Skuteczna koagulacja wymaga odpowiedniej ilości dodawanego koagulanta. Ta wymagana ilość koagulanta, nazywana ilością progową, zależy od wartościowości jonów koagulujących. Im wyższa jest wartościowość tych jonów tym niższa jest ich liczba progowa. Zależność tą wyraża reguła Schulza – Hardy’ego, wg której dla jonów jednowartościowych o znaku przeciwnym do ładunku zolu wartość progowa wynosi 25 – 150 mol/m3, dla dwuwartościowych 0,5 – 2,0 mol/m3, a dla trójwartościowych 0,01 – do 0,1 mol/m3. 4. Chemiczne zapotrzebowanie tlenu (ChZT) Chemiczne zapotrzebowanie tlenu (ChZT) jest to pojecie umowne oznaczające ilość tlenu w mg/dm3 pobranego z utleniacza (w umownych warunkach) na utlenianie w ściekach związków organicznych i niektórych nieorganicznych, jak na przykład soli żelaza (II), azotynów, siarczynów, siarczków i innych. Oznaczenie ChZT musi być wykonane w ściśle określonych warunkach, gdyż rodzaj utleniających związków i stopień utlenienia mogą się zmieniać w szerokim zakresie, zależnie od takich czynników, jak na przykład skład ścieków, struktura związków, rodzaje substancji utleniających, stężenie odczynników, temperatura, czas reakcji i inne. Do oznaczania ChZT ścieków stosuje się najczęściej metodę dwuchromianową. W wodach oznacza się także tzw. utlenialność a więc chemiczne zapotrzebowanie tlenu metodą nadmanganianową. Metoda dwuchromianowa ma tę wyższość nad innymi, że jest prosta, odtwarzalna i daje wysoki stopień utleniania 95-100% wartości teoretycznej dla większości związków organicznych. Nie ulegają utlenieniu benzen, toluen i tylko w niewielkim stopniu pirydyna. LITERATURA 1. Hermanowicz W., Fizyczno-chemiczne badanie wody i ścieków, Arkady, Warszawa, 1999. 2. Dymaczewski Z., Poradnik eksploatatora oczyszczalni ścieków, Polskie Zrzeszenie Inż. i Tech. Sanitarnych, Poznań,1997. 3. Minczewski J., Marczenko Z., Chemia analityczna. Chemiczne metody analizy ilościowej, Wydawnictwo naukowe PWN, Waszawa 1998. 4. Anielak, Chemiczne i fizykochemiczne oczyszczanie ścieków, Wydawnictwo naukowe PWN, Waszawa 2000. II. CZĘŚĆ DOŚWIADCZALNA 1. Cel ćwiczenia: Celem ćwiczenia jest: - ocena możliwości oczyszczania ścieków metodami fizykochemicznymi - sedymentacja, koagulacja, jako operacjami jednostkowymi stosowanymi w układach technologicznych uzdatniania wody, 1.1. Fizykochemiczne usuwanie zawiesin Przed przystąpieniem do oczyszczania ścieków pobrać próbki do oznaczenia chemicznego zapotrzebowania tlenu (ChZT). Ścieki poddać oczyszczaniu metodą sedymentacji oraz koagulacji. 1.1.1. Sedymentacja Badaną próbkę o objętości 0,5 dm3 umieścić leju Imhoffa i po upływie 5, 10, 20, 30, 45, 60 minut od chwili napełnienia odczytać objętość osiadłych zawiesin. Na trzy minuty przed każdym odczytem lej Imhoffa należy kilka razy obrócić wokół osi pionowej, tak aby opadły cząstki zawiesin przyczepione do ścianek leja. Wynikiem oznaczenia jest objętość zawiesin wyrażona w cm3/dm3 po określonym czasie przebywania badanej próbki w leju. Kinetykę osadzania zawiesin przedstawić graficznie na wykresie w układzie współrzędnych umieszczając na osi x czas obserwacji, na osi y procent objętości zawiesin w danym czasie odniesiony do objętości zawiesin w godzinnym odstawaniu. W cieczy nadosadowej oznaczyć ChZT i obliczyć efektywność usuwania zanieczyszczeń ze ścieków. 1.1.2. Koagulacja Do leja Imhoffa odmierzyć 0,5 dm3 ścieków i dodać wskazanego przez prowadzącego koagulantu w ilości zgodnej z regułą Schulza – Hardy’ego. Po upływie 5, 10, 20, 30, 45, 60 minut od chwili napełnienia odczytać objętość osiadłych zawiesin zgodnie z metodyka opisana powyżej. Kinetykę osadzania zawiesin przedstawić graficznie na wykresie. W cieczy nadosadowej oznaczyć ChZT i obliczyć efektywność usuwania zanieczyszczeń ze ścieków. 1.2. Wyznaczanie skuteczność usuwania zawiesin 1.2.1. Oznaczanie ChZT - metodą dwuchromianową (PN-74/C-04578) Przy oznaczaniu ChZT przeszkadzają chlorki, które tylko w obecność związków węglowych zużywają dwuchromian, utleniają się do chloru gazowego, ulatniającego się z roztworu. W tym przypadku od wartości ChZT należy odjąć poprawkę na chlorki oznaczone w osobnej próbce. Ponieważ 1mg Cl- jest równoważny 0,226 mg O2, poprawka na chlorki wynosi ilość mg/dm3 Cl- pomnożona przez 0,226. Ujemny wpływ chlorków można wyeliminować, dodając jako czynnika kompleksującego siarczanu rtęci. W obecności dużych ilości amoniaku, amin organicznych lub azotowych związków organicznych, jeżeli nie ma katalizatora, zachodzi powolna (w ciągu wielu godzin) redukcja dwuchromianu. Obok właściwego oznaczenia ChZT wykonuje się także nastawienie miana Fe(NH4)2(SO4)2 oraz ślepą próbę. • Nastawianie miana Fe(NH4)2(SO4)2 10 cm3 0,25 N K2Cr2O7 dodać do 20 cm3 wody destylowanej w kolbie stożkowej. Dodać 30 cm3stężonego H2SO4, ostudzić, dodać 3 krople siarczanu ferroiny i odmiareczkować roztworem Fe(NH4)2(SO4)2, aż do zmiany barwy z niebieskawo-zielonej do czerwononiebieską. • Oznaczenie ChZT Do kolby okrągłodennej dodać 20 cm3 próbki badanej. Następnie wrzucić parę kawałków kaolinu i dodać 10 cm3 0,25 n K2Cr2O7. Mieszając bardzo ostrożnie dodać 30 cm3 stężonego H2SO4 (uważać aby nie zawrzało). Kolbę połączyć z chłodnicą i ogrzewać przez 10 minut od momentu gdy roztwór zawrze. Po zakończeniu utleniania kolbę ostudzić i spłukać wewnętrzną część chłodnicy wodą destylowaną (około 50 cm3). Ostudzić do temperatury pokojowej, dodać 3 krople siarczanu ferroiny i odmiareczkować roztworem Fe(NH4)2(SO4)2, aż do zmiany barwy z niebieskawo-zielonej do czerwono-niebieską. Wykonać równoległą próbę ślepą stosując ten sam zestaw odczynników z 20 cm3 wody destylowanej zamiast próbki. ChZT obliczyć ze wzoru: X=(a-b)*N*8000/V [mg O2/dm3] gdzie a- objętość Fe(NH4)2(SO4)2 zużyta na zmiareczkowanie próby kontrolnej [cm3]; b- objętość Fe(NH4)2(SO4)2 zużyta na zmiareczkowanie próbki ścieków [cm3]; N- normalność Fe(NH4)2(SO4)2; V- objętość próbki ścieków [cm3] • Efektywność usuwania zanieczyszczeń organicznych. Efektywność procesu oczyszczania odcieków (E), określającą usuniętą część zanieczyszczeń obliczyć według zależności: E = (1 – So/Ss) * 100 [%] gdzie: Ss – stężenie zanieczyszczenia w odciekach surowych, So - stężenie zanieczyszczenia w odciekach oczyszczonych, 1.2.2. Wyznaczanie mętności metodą nefelometryczną Oznaczanie mętności metodą nefelometryczną polega na porównaniu intensywności światła rozproszonego przez cząstki koloidów i zawiesin z odpowiednio przygotowanymi wzorcami krzemionkowymi. Intensywność rozproszonego światła jest proporcjonalna do mętności badanej wody. • Pomiar mętności metodą nefelometryczną Pomiar mętności wykonać dla ścieków surowych oraz dla ścieków oczyszczonych metodą sedymentacji i koagulacji. Przeprowadzić kalibrację nefelometru według wskazówek prowadzącego. Następnie wlać próbkę badana do naczynia pomiarowego nefelometru i umieścić je w gnieździe pomiarowym. Naczynie pomiarowe przykryć osłoną odcinającą dopływ światła. Wykonach pomiar mętności w jednostkach NTU (Nephelometric Turbidity Unit – nefelometryczna jednostka mętności). Wyniki zamieścić w tabeli. Wielkość mierzona Wartość normalność roztw. K2Cr2O7 obj. Fe(NH4)2(SO4)2 zużyta do nastawiania miana normalność roztworu Fe(NH4)2(SO4)2 obj. Fe(NH4)2(SO4)2 zużyta do miareczkowania próbki ślepej obj. Fe(NH4)2(SO4)2 zużyta do miareczkowania próbki ścieków ChZT ścieków surowych Mętność ścieków surowych Koagulant……………………… masa koagulantu Sedymentacja/Koagulacja objętość zawiesin t=5 min objętość zawiesin t=10 min objętość zawiesin t=20 min objętość zawiesin t=30 min objętość zawiesin t=45 min objętość zawiesin t=60 min ChZT ścieków oczyszczonych Efektywność usuawania Mętność ścieków oczyszczonych Jednostka POLITECHNIKA GDAŃSKA WYDZIAŁ CHEMICZNY KATEDRA TECHNOLOGII CHEMICZNEJ SPRAWOZDANIE Z ĆWICZEŃ LABORATORYJNYCH CHEMIA ŚRODOWISKA BADANIE PARAMETRÓW FIZYKOCHEMICZNYCH ŚCIEKÓW PROWADZĄCY: NAZWISKA OSÓB WYKONUJĄCYCH ĆWICZENIE: 1. 2. 3. 4. 5. KIERUNEK STUDIÓW: GRUPA: DATA WYKONANIA ĆWICZENIA: DATA ODDANIA SPRAWOZDANIA: GDAŃSK 2010/11