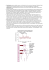= const dla stałej temp.
Transkrypt
= const dla stałej temp.
DUŻE KOŁO CHEMICZNE 3GA 2012/2013 ZAJĘCIA 2: RÓWNOWAGI GAZOWE opr. Kuba Skrzeczkowski RÓWNOWAGI GAZOWE – NOTATKA PUNKT 1. Spora część reakcji nie zachodzi do końca, a jedynie do pewnego momentu (wtedy istnieje w układzie substrat jak i produkt). Moment ten nazywa się stanem równowagi. Reakcje nazywa się odwracalnymi. PUNKT 2. Weźmy dowolną reakcję przebiegającą w fazie gazowej. N2 + 3 H2 2 NH3 W stanie równowagi (czyli gdy reakcja nie będzie zachodziła w żadnym kierunku) w układzie będzie istniał zarówno substrat jak i produkt, to jest: azot, wodór, amoniak. Ich ilości opisuje wielkość gazowa stała równowagi, Kp (stała ta opisuje ciśnienia substratów i produktów w stanie równowagi). Nie pomylić ze stałą szybkości (małe k). = const dla stałej temp. Teraz wyjaśniamy co tutaj się stało: W gazowej stałej równowagi ciśnienia produktów są w liczniku natomiast ciśnienia substratów w mianowniku. Ciśnienia reagentów są podzielone przez ciśnienie standardowe (równe ok. 101325 Pa) tak, aby stała równowagi nie miała jednostki (była bezwymiarowa). Ciśnienia podzielone przez ciśnienie standardowe są podnoszone do potęg które są współczynnikami w równaniu reakcji. ĆWICZENIE 1. Dla poniższych reakcji zapisz wyrażenia będące stałymi równowagi (wszystkie reagenty są w stanie gazowym): (a) SnCl2 + Cl2 SnCl4 (b) NO + ½ O2 NO2 (c) 2H2S + 3O2 2SO2 + 2H2O ĆWICZENIE 2. Z równomolowej mieszaniny wodoru i jodu syntezowano HI. Stała ciśnieniowa reakcji H2 + I2 2HI w pewnej temperaturze wynosi 900. Oblicz jaki procent ciśnienia HI stanowi ciśnienie wodoru? ĆWICZENIE 3. Przeprowadzano reakcję A + 2B 3C. W stanie równowagi ciśnienia A, B, C wynosiły odpowiednio: 132000 Pa, 101000 Pa, 52000 Pa. PUNKT 3. Dana jest mieszanina gazów, np. A, B, C która trzymana jest pod ciśnieniem p całk. Wykazać, że na/ncałk = pa/pcałk gdzie ncałk to suma liczb moli A, B, C. PUNKT 4. Przechodzimy do zadań trudniejszych. Na początku parę wskazówek. Zadania z równowag najlepiej rozwiązywać poprzez wykonanie tabelki (możecie bilansować najlepiej albo na liczbach moli albo na ciśnieniach). DUŻE KOŁO CHEMICZNE 3GA 2012/2013 ZAJĘCIA 2: RÓWNOWAGI GAZOWE opr. Kuba Skrzeczkowski Pamiętajcie też o równaniu Clapeyrona oraz żeby wykorzystywać ciśnienie całkowite podane w treści zadania – nie wiem czemu ale uczniowie o nim zawsze zapominają: przypomnijmy, że jest to suma ciśnień cząstkowych wszystkich substancji. No to dajemy czadu! (O nie!) Podsumowując: Tabelki na liczbach moli/ciśnieniach Równanie Clapeyrona (związek między v, n, p, T). Ciśnienie całkowite – suma ciśnień składników! ĆWICZENIE 1. (Zadanie 3 z XXV Konkurs Politechniki Warszawskiej) W naczyniu o pojemności 1 dm3 umieszczono 2,4223 g I2, po czym usunięto powietrze i ogrzano do temperatury 1073 K. W stanie równowagi reakcji: I2 (g) 2 I(g) ciśnienie całkowite w naczyniu wynosiło 89459 Pa. Oblicz stopień dysocjacji I2 i stałą równowagi reakcji Kp dysocjacji jodu. ĆWICZENIE 2. (Zadanie 3 z XXIV Konkurs Politechniki Warszawskiej) Do reaktora wprowadzono 0,5 mola NOCl i ogrzano do temperatury 473 K. W stanie równowagi reakcji: 2 NOCl (g) 2 NO(g) + Cl2 (g) ciśnienie w reaktorze wynosiło 101325 Pa, a ciśnienie cząstkowe chloru 12052 Pa. Oblicz następujące rzeczy: a) stopień dysocjacji NOCl i stałą równowagi reakcji Kp; b) objętość reaktora i gęstość mieszaniny gazowej w stanie równowagi; c) ciśnienie, pod którym stopień dysocjacji NOCl osiągnąłby wartość 0,4. ĆWICZENIE 3. Zmieszano duże ilości stałego jodku amonu oraz chlorku amonu a otrzymaną mieszaninę umieszczono w zamkniętym pojemniku (z którego wcześniej usunięto powietrze) i zaczęto go ogrzewać do temperatury 630 K. Zaczęły się ustalać stany równowagi reakcji: NH4Cl(s) NH3(g) + HCl(g) o stałej ciśnieniowej K1 NH4I(s) NH3(g) + HI(g) o stałej ciśnieniowej K2 Wyprowadź wzór na ciśnienie HCl oraz na ciśnienie HI w równowagowej mieszaninie gazowej jako funkcję stałych równowagi K1, K2 oraz ciśnienia standardowego. ĆWICZENIE 4 Zależność prężności pary nad stałym czterochlorkiem selenu, SeCl 4, od temperatury, opisuje równanie log p = 11,310 – 3911,6 T-1 (p w mmHg, T w K) (i) (ii) Przekształć to równanie w taki sposób, aby argument funkcji logarytmicznej był wielkością bezwymiarową. Oblicz stałą KP (bezwymiarową) SeCl4(s) SeCl2(g) + Cl2(g) w t = 170°C.