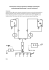Międzynarodowa Konferencja Naukowo‐Szkoleniowa Państwowej
Transkrypt
Międzynarodowa Konferencja Naukowo‐Szkoleniowa Państwowej
Testy aglutynacji lateksowej w diagnostyce medycznej Co łączy klasyczną hemaglutynację i nowoczesną immunodiagnostykę? Otóż ta druga w erze przeciwciał monoklonalnych sięgnęła po pomysł podpatrzony w samej naturze- okrągłe cząstki opłaszczone przeciwciałem (antygenem) zlepiają się (aglutynują) w obecności antygenu (przeciwciała), a efekt jest widoczny gołym okiem lub przy użyciu nefelometru- zupełnie jak podczas hemaglutynacji niezgodnych grupowo krwinek. Zasada działania testów lateksowych Nośnikiem szeroko używanym w diagnostyce medycznej jest lateks. Kulki lateksu łatwo opłaszcza się białkami, zaś średnica kulek jest na tyle mała, że zachowują się one w wodzie jak jednorodna zawiesina. Można zatem przyłączać do cząstek lateksu antygeny (podczas wykrywania przeciwciał) lub przeciwciała (przy screeningu antygenów). Powinowactwo antygen-przeciwciało zbliża do siebie cząstki lateksu, sieciuje je między sobą (aglutynacja) i strąca największe kompleksy z roztworu, co widać gołym okiem jako osad lub nagle powstałą heterogenność mieszaniny (patrz rycina). Screeningowe testy aglutynacji lateksowej (wizualne) Aglutynacja cząsteczek lateksu jest świetnym sposobem na szybki screening np.w diagnostyce mikrobiologicznej. Rutynowo wykonuje się dziś oznaczanie koagulazy związanej rodzaju Staphylococccus (tzw. clumping factor), która jest czynnikiem zjadliwości szczepów S. aureus. Także rutynowo prowadzi się wstępne szeregowanie paciorkowców do grup serologicznych na podstawie obecności antygenów grupowych na powierzchni tych bakterii. Taki test przesiewowy pozwala odróżnić paciorkowce chorobotwórcze od flory fizjologicznej i jest wstępem do dalszej identyfikacji tych drobnoustrojów. Testów tego typu jest więcej, są to metody jakościowe, zgrubne, do których wykonania wystarczy kilka minut. Nie są to metody czułe, ale wystarczające przy wstępnym screeningu. Wykonuje się je dziecinnie prosto: na okrągłe pole testowe nakrapia się kroplę zawiesiny lateksu, dodaje się pojedynczą, czystą kolonię bakteryjną i miesza, czekając na aglutynację w postaci widocznego strątu. Testy lateksowe do ilościowej oceny nefelometrycznej Testy immunoaglutynacyjne można wykorzystać także w czułej analizie ilościowej antygenów lub przeciwciał w surowicy czy moczu. Dzięki nefelometrii (pomiar światła rozproszonego przez zmętnienie mieszaniny) możliwe jest wykrycie nawet niewielkiej aglutynacji oraz oszacowanie ilościowe na podstawie krzywej wzorcowej stężenia badanego czynnika. Takie testy stosowane są m.in w diagnostyce hsCRP (białko C-reaktywne, oznaczenie wysokiej czułości), przy poszukiwaniu autoprzeciwciał (reumatoidalne zapalenie stawów, toczeń układowy i inne) czy też w diagnostyce chorób bakteryjnych i wirusowych (np. antygen streptolizyna-O, przeciwciała przeciwko H. pylori i wiele innych) Marzena Pieronkiwicz Zdjęcie testu Slidex pobrano ze strony reklamowej producenta. Testy aglutynacji latekswej Niezastąpione w nowoczesnej diagnostyce laboratoryjnej Przechowywanie próbek w biotechnologii: „jak”, „gdzie”, i „jak długo”? (I) Temat archiwizacji próbek jest istotny zarówno dla naukowców, jak i dla klinicystów. Czy to podczas realizacji projektu badawczego, czy to do późniejszego wykorzystania, wreszcie- dla celów terapeutycznych. Dla niektórych typów materiałów istnieje consensus co do sposobu przechowywania, natomiast dla innych nie ma żadnych konkretnych wytycznych i tylko od załogi laboratorium i posiadanego sprzętu zależy, jak i czy w ogóle jest on bankowany. W części pierwszej zajmiemy się materiałami tkankowymi i komórkowymi. Żywotne hodowle komórkowe eukariotyczne, gamety i komórki macierzyste Zachowanie w dobrej kondycji wrażliwych, osłoniętych jedynie błoną plazmatyczną komórek zwierzęcych jest nie lada wyzwaniem. Oczywiście zatrzymanie ich metabolizmu jest możliwe jedynie poprzez zamrożenie, jednak woda podczas mrożenia tworzy kryształy, które niczym włócznie przebijają na wskroś mrożone komórki. Dlatego procedura mrożenia jest bardzo ściśle określona i wymaga specjalistycznej aparatury. Komórki przed mrożeniem są delikatnie traktowane, odpłukiwane z medium hodowlanego, zastępowanego roztworem zawierającym krioprezerwant (najszerzej używanym jest DMSO, chociaż wybór środka zależy od typu komórek). Jego funkcją jest nie dopuścić do tworzenia się kryształów i do nadmiernego obkurczania się komórek w stanie zamrożenia. Samo zamrażanie musi być na tyle szybkie, żeby komórki nadmiernie się nie obkurczyły, ale na tyle wolne, by nie doprowadzić do ich lizy. Komórki ssacze najczęściej poddaje się mrożeniu z szybkością 1-3 stopni Celcjusza na minutę, schładzając je docelowo do temperatury poniżej -130 stopni. Jest jeszcze druga technika zamrażania, zwana witryfikacją, czyli zeszkleniem. Polega ona na tak szybkim zamrożeniu komórek, by ich roztwór zamienił się nie w kryształy lodu, ale w amorficzne ciało stałe podobne do szkła. Odbywa się to poprzez nagłe włożenie do ciekłego azotu i nadanie ruchu próbce podczas zamrażania, tak by ciekły azot maksymalnie szybko odbierał jej ciepło. Testy aglutynacji latekswej Niezastąpione w nowoczesnej diagnostyce laboratoryjnej Przechowywanie po zamrożeniu odbywa się albo nad ciekłym azotem, w jego parach (-140 do -180 stopni), albo w cieczy (-196). Rozmrażanie komórek polega najczęściej na raptownym rozgrzaniu do 37 stopni i szybkim odpłukaniu środka konserwującego, by nie dopuścić do zatrucia komórek i szoku osmotycznego. Materiał roślinny pochodzący z zawiesin komórkowych mrozi się w podobny sposób. Żywotne linie bakteryjne i drożdżowe Bakterie i drożdże, z racji mniej skomplikowanego metabolizmu, naturalnych przystosowań do trudnych warunków środowiska i posiadania ściany komórkowej, łatwiej jest zachować przy życiu w stanie zamrożenia. Oczywiście są mikroby wrażliwe, wymagające odpowiedniego przygotowania przed krioprezerwacją, jednak poczciwa E. coli, czy S. cerevisiae, jak ii wiele innych gatunków nie wymagają skomplikowanych procedur. Kolonie w fazie wzrostu logarytmicznego (nigdy w fazie stacjonarnej ani obumierania!) zawirowuje się i zawiesza w 15% roztworze glicerolu. Voila, teraz po prostu nasze bakterie przechowujemy w -20 stopniach. Do krótkotrwałego przechowywania (kilkudniowego) można wykorzystać schładzane w lodówce szalki lub skosy agarowe, czasami także podłoża płynne. Istnieje także możliwość wysuszenia naszych mikroogranizmów z zachowaniem częściowej żywotności (nawet >50%) przy użyciu specjalnej aparatury do sublimacji. W zamrożeniu z kultur odparowywana jest woda, dzięki czemu otrzymujemy liofilizat, który może być przechowywany przez długi czas w zamrożeniu czy też nawet w temperaturze pokojowej bez dostępu wody. Tą technologią suszone są dobrej jakości drożdże piekarskie i winiarskie, które kupujemy w saszetkach w sklepach spożywczych. Ekstrakty komórkowe Ekstrakty komórkowe nie muszą być utrzymane przy życiu, dlatego istnieje wiele sposobów na ich przechowywanie. Jeżeli zależy nam jedynie na materiale DNA lub plazmidowym, można po prostu zawiesinę lub tkankę zamrozić w buforze. Mniej kłopotliwe w transporcie są liofilizaty, które bez dostępu wody można przechowywać w temperaturze pokojowej lub w lodówce. Do otrzymania lizatów o jakości wystarczającej do badań białek należy się bardziej przyłożyć. Jeżeli nasze eksperymenty zakładają użycie zdenaturowanych polipeptydów- nie ma większego problemu, wystarczy inhibicja proteolizy i zamrożenie lizatu. Jeżeli natomiast potrzebne nam są białka natywne, postępujemy z reguły tak, jak z hodowlami komórkowymi- zawieszamy lizat w odpowiednim buforze (zawiera inhibitory proteaz, chelatory i/lub krioprotektanty), następnie zanurzamy w ciekłym azocie i przechowujemy w co najmniej -70 stopniach. Jeżeli białka które badamy są stabilne (np. kolageny) lub występują w dużych ilościach w komórce (albuminy, kazeina), możemy spróbować liofilizacji jako tańszej i mniej kłopotliwej alternatywy. Przechowywanie krótkoterminowe w lodówce, od kilku dni do nawet miesiąca czasu jest możliwe przy zastosowaniu buforów zawierających substancje bakteriobójcze i inhibitory proteaz. Wycinki tkankowe i bioptaty Konserwacja skrawków do badań histopatologicznych jest standardowo wykonywana w pracowniach patologii i polega na maceracji wycinka tkankowego w zbuforowanym roztworze 10% formaliny, następnie zaś zatopieniu skrawka w kostce parafiny. Tzw. „bloczki” parafinowe można przechowywać latami bez dużej straty właściwości biologicznych. O ile RNA w takich kostkach ulega szybkiej lizie, o tyle chromatyna jądrowa i większość białek (aczkolwiek te częściowo denaturują) pozostaje nietknięta. Możliwe jest więc prowadzenie analiz retrospektywnych na DNA (techniki biologii molekularnej i FISH) oraz badań immunohistochemicznych i histochemicznych. By przygotować preparat mikroskopowy i wybarwić tkankę należy z bloczka odciąć na mikrotomie odpowiednie skrawki, „odparafinować” je i wybarwić. Krótkotrwałe (kilka dni lub tygodni) przechowywanie preparatów tkankowych możliwe jest w zbuforowanym roztworze formaliny. Rozmazy cytologiczne W zależności od typu rozmazu (szpik i krew obwodowa, materiał z biopsji aspiracyjnych BAC, cytologia ginekologiczna, rozmazy płynów wysiękowych itd.) stosuje się różne techniki wykonywania rozmazów i różne barwienia. Przechowywanie takich rozmazów polega w dużym uogólnieniu na przygotowaniu niebarwionych szkiełek z naniesionym odpowiednio materiałem w kilku (co najmniej 2) powtórzeniach, dobrym osuszeniu szkiełek, a następnie archiwizacji ich w suchym i ciemnym pomieszczeniu. Materiał utrwalony na szkiełkach zwykle nadaje się do barwień cytochemicznych, czasami możliwe jest otrzymanie małych ilości DNA z takich próbek do badań molekularnych, ale jest ono znacznie gorszej jakości (i w mniejszej ilości) niż z bloczków parafinowych. Różnie bywa z oznaczeniami białek: są one często mocno zdenaturowane i mogą nie wykazywać właściwości antygenowych niezbędnych np. do immunolokalizacji przeciwciałami mono, a nawet poliklonalnymi. Preparaty barwione niektórymi barwnikami strąceniowymi można przechowywać w ciemnym pomieszczeniu przez dłuższy czas, jednak część barwień bleknie już po kilku dniach (np. FAG) lub tygodniach (barwienia immunofluorescencyjne, np. FISH) Jądra komórkowe do techniki FISH Do badań cytogenetycznych wykorzystuje się bioptaty tkankowe lub świeże zawiesiny komórkowe. Gdy nie jest możliwe wykonanie badania FISH od razu, lub gdy zaistnieje potrzeba przechowania prób pochodzących z zawiesiny komórek (np.w onkologii), można je przechować w dwojaki sposób: albo w postaci utrwalonych, niewybarwionych szkiełek przechowanych w < -70 stopniach, lub jako zawiesina komórek utrwalona w mieszaninie metanol-kwas octowy, przechowywana w zamrożeniu. Bardziej polecana jest ta druga metoda, gdyż materiał po wykonaniu FISHa jest lepszej jakości niż po nałożeniu na gotowe, przemrożone szkiełka. Co do skrawków parafinowych do FISH, postępowanie nie różni się od tego opisanego w punkcie 4. Piśmiennictwo: 1. Riggio B. A Beginner’s Guide to Storing Biological Materials. Bitesize Bio, 30 July 2012. 2. El-Danasouri I., Selman H. Vitrification versus conventional cryopreservation technique. MEFSJ, Bioline, 2005, 10, 3: 205-206. 3. Millipore technical publications: Cell Lysate Extracts-General Protocols, 2007. Technika FISH — od czego zacząć? Planujesz rozpoczęcie badań metodą FISH i nie bardzo wiesz, jak się do tego zabrać? W krótkiej serii artykułów o technice FISH przekonamy Cię, że metoda ta nie jest wcale trudna i że dzięki naszym wskazówkom bez problemu zaprojektujesz eksperyment, przeprowadzisz hybrydyzację i będziesz się cieszyć doskonałej jakości zdjęciami. W serii tej opowiemy również o nowościach odczynnikowych, które ostatnio ukazały się na rynku i podpowiemy Wam jakie narzędzia bioinformatyczne ułatwią Wam pracę z tą techniką. Od czego zacząć? Metoda FISH (ang. Fluorescence In SituHybridization) jest dość kosztowna (koszt przygotowania jednego preparatu to zazwyczaj 500-1200 PLN, niższe ceny proponuje wchodząca na rynek z sondami SureFISH firma Agilent Technologies, polski dystrybutor Perlan Technologies). Metoda FISH wymaga stosowania zarówno bardzo precyzyjnych protokołów, jak i sprawdzonych, pewnych odczynników. Jest również narażona na błędy, które często powodują zmarnowanie nie tylko włożonej w eksperyment pracy, ale przede wszystkim stratę bardzo kosztownych sond. Dlatego, aby dobrze przygotować się do pracy z tą techniką należy przygotować odpowiedni sprzęt i odczynniki. Potrzebne odczynniki (w zależności od protokołu i używanych sond): potrzebne są odczynniki takie jak: ksylen do odparafinowania, etanol, bufory (w tym bufor hybrydyzacyjny i bufory płuczące), sondy, DAPI, proteaza, woda wolna od nukleaz, czasem formamid i SSC. Materiał do badań: skrawek parafinowy, preparat mikroskopowy, utrwalone chromosomy na szkiełku podstawowym. Przechowywanie przygotowanego materiału naniesionego na szkiełko: skrawek parafinowy – temperatura pokojowa, pozostałe: -20 °C. Potrzebny sprzęt: — lodówka z zamrażalnikiem — mikroskop fluorescencyjny z kamerą — odpowiednie filtry do mikroskopu (jeśli nie jesteś pewien, czy dana sonda nadaje się pod konkretny rodzaj filtra, który posiadasz — skontaktuj się z producentem sondy lub dostawcą mikroskopu). Może się zdarzyć, że filtry trzeba dokupić— w zależności od rodzaju mikroskopu filtry kosztują od kilku do kilkunastu tysięcy złotych. — dwie łaźnie wodne — hybrydyzator — naczynia Coplina — klej do dętek — lakier do paznokci — pudełko do przechowywania preparatów — olejek immersyjny — szkiełka nakrywkowe Protokół: — bardzo dokładny protokół i cenne wskazówki dotyczące techniki FISH można znaleźć tutaj. – Zobacz też protokół na FISH EGFR: http://dolinabiotechnologiczna.pl/odczynniki/protokol-fish-na-egfr/ Testy aglutynacji latekswej Niezastąpione w nowoczesnej diagnostyce laboratoryjnej dla Ekspansja powtórzeń trójnukleotydowych jako podłoże chorób genetycznych Niewielu z Was zapewne słyszało nazwę grupy chorób genetycznych “zespoły ekspansji powtórzeń trójnukleotydowych” (ang. trinucleotide repeat expansion disorders, TREDs). Ale choroba Huntingtona na pewno już wszystkim z Was nasuwa pewne skojarzenia. W grupie TREDs znajdują się także takie zespoły wad wrodzonych jak zespół łamliwego chromosomu X (Fra-X), ataksje móżdżkowo-rdzeniowe (SCA), albo dystrofia miotoniczna. Właściwie tych zaburzeń nie łączy nic- poza etiologią molekularną. Żeby zrozumieć, skąd biorą się zespoły ekspansji powtórzeń trójnukleotydowych, musimy przyjrzeć się uważnie strukturze DNA. Wiele rejonów naszego genomu, tych kodujących i niekodujących, posiada w swoim składzie tzw. mikrosatelity, czyli powtarzające się motywy sekwencji, złożone z kilku nukleotydów. Ilość powtórzeń w takich mikrosatelitach jest bardzo zmienna w populacji- dzięki tej zmienności możliwe jest np. identyfikowanie osób w genetyce sądowej. Unikatowym wariantem powtórzeń mikrosatelitarnych są powtórzenia tripletowe, np. CTGCTGCTGCTGCTGCTG… Sekwencje tego typu są wyjątkowe z dwóch powodów: po pierwsze, gdy znajdują się w rejonie kodującym, zmiana ilości powtórzeń tylko nieznacznie uszkadza białko (zwiększając bądź zmniejszając liczbę aminokwasów, ale nie zmieniając całej C-końcowej sekwencji, czyli ramki odczytu). Po drugie, powtórzenia trzech nukleotydów tworzą często na poziomie pojedynczej nici DNA lub RNA motywy spinki do włosów, czyli z angielska „hairpin” (pokazane na ryc. 1). Takie „spinki” są bardzo trwałe i mogą zaburzać mechanizmy transkrypcji i edycji RNA, co powoduje symptomy choroby nawet bez ingerencji na poziomie białka. Rycina 1. Struktura spinki do włosów formowana przez serię powtórzeń trójnukleotydowych Tworzenie się „spinek” jest zresztą główną siłą sprawczą TREDs i w ogóle zmienności liczby powtórzeń – na etapie replikacji jedna z nici w obrębie sekwencji mikrosatelitarnej może „zawinąć się”, co powoduje dobudowanie do niej przez polimerazę większej liczby kolejnych powtórzeń, niż wynikałoby to z komplementarności DNA. Mechanizm działa też w drugim kierunku, zmniejszając liczbę powtórzeń w kolejnych cyklach replikacji (Rycina 2). Rycina 2. Powtórzenia w kolejnych cyklach replikacji. Ze względu na podobieństwo mechanizmów powstawania TREDs, a nie na wspólne geny zaangażowane w patogenezę tych chorób, manifestacja kliniczna jest bardzo różna. Prześledzimy dwa przykłady: chorobę Huntingtona, w której powtórzenia znajdują się w obrębie sekwencji kodującej, oraz zespół Fra-X, w którym zaburzenie na poziomie DNA nie wpływa na strukturę białka, ale na jego ekspresję. CHOROBA HUNTINGTONA Choroba Huntingtona (ang. Huntington’s disease, HD) zwana jest pląsawicą ze względu na typowe zaburzenia neurologiczne, powodujące niekontrolowane ruchy kończyn u osoby chorej Poza postępującą niepełnosprawnością fizyczną chorzy stopniowo doznają otępienia umysłowego i żyją przeciętnie około 20 lat od momentu zauważenia objawów. Choroba zwykle ujawnia się w wieku dorosłym, chociaż istnieje odwrotnie proporcjonalna zależność pomiędzy ilością powtórzonych trójek nukleotydowych a wiekiem ujawnienia schorzenia. W chorobie Huntingtona genem, w którym dochodzi do multiplikacji powtórzeń CAG jest gen HTT, huntingtina. Ekspansja trójek nukleotydowych zachodzi w sekwencji kodującej białko, powodując zwiększenie ilości powtórzeń aminokwasu glutaminy (tzw. trakt poliQ). W prawidłowej huntingtinie znajduje się poniżej 26 powtórzeń CAG, natomiast liczba ta może przeroczyć 40, powodując pełnoobjawową pląsawicę. HD dziedziczy się w sposób autosomalny dominujący, wystarczy więc jedna uszkodzona kopia HTT do zainicjowania choroby. Niestety mimo ciągłych badań,wciąż nie do końca wiadomo, dlaczego uszkodzenie Htt powoduje neurologiczne symptomy choroby. Funkcje huntingtiny są bardzo róznorodne, ulega ona ekspresji w wielu tkankach i jest związana funkcjonalnie z co najmniej 100 innymi białkami. Najważniejsza w procesie neurodegeneracji wydaje się być funkcja antyapoptotyczna tego białka- zaburzenia jego struktury przez dodatkowe ciągi glutaminowe mogą tę funkcję osłabiać. Co jednak istotniejsze, sama glutamina lub trakt poliQ stanowić może element najbardziej uszkadzający neurony. Niefunkcjonalne zmutowane białko jest cięte na fragmenty i rozkładane, ale łańcuchy poliglutaminowe zostają nietknięte. Peptydy złożone z poliglutaminy agregują ze sobą, dając objawy typowe dla neurodegeneracyjnej choroby spichrzeniowej. Ten sam mechanizm występuje także w innych chorobach z ekspansją poliQ, np. w SCID.Drugą wspólną cechą HD i SCID jest antycypacja genetyczna. To zjawisko powoduje narastanie ilości powtórzeń w kolejnych pokoleniach i coraz młodszy wiek ujawnienia choroby. ZESPÓŁ ŁAMLIWEGO CHROMOSOMU X Zespół łamliwego chromosomu X (ang. fragile X, Fra-X) to najczęstsza spośród chorób związanych z tzw. łamliwością chromosomu X. Fra-X jest pierwszą chorobą z grupy TREDs, którą opisano w literaturze (rok 1991). Choroba objawia się licznymi zmianami dysmorficznymi, takimi jak pociągła twarz, duże uszy, płaskostopie, czy też duże jądra u mężczyzn. Zaburzenia intelektualne są dużo mocniej wyrażone- chorych cechuje zespół zachowań zaliczanych do spektrum autyzmu oraz zaburzenia funkcji poznawczych o bardzo różnym nasileniu (zależnym od penetracji defektu w FRM1). Zespól łamliwego chromosomu X Powodowany jest przez zwiększenie ilości powtórzeń CGG w obrębie sekwencji 5′ UTR genu FRM1. Uszkodzony gen ulega zmniejszonej ekspresji, powodując niedobór białka FRMP, niezbędnego do prawidłowego rozwoju neuronów. Ze względu na występowanie tego genu na chromosomie X, praktycznie wszyscy mężczyźni obarczeni defektem chorują, podczas gdy za sprawą atenuacji u kobiet znacznie mniejszy odsetek wykazuje symptomy choroby. Mimo niemendlowskiego obrazu dziedziczenia, choroba jest uznana za autosomalną dominującą.Nazwa zespołu Fra-X jest związana z pierwszą metodą diagnostyki genetycznej tego zaburzenia, w której poszukiwano łamliwych miejsc w kariotypie komórek hodowanych w ubogofolianowym podłożu. Metoda była mało wiarygodna, stąd szybko zastąpiono ją techniką PCR. Oprócz typowego Fra-X zidentyfikowano jeszcze 3 inne zespoły wad wrodzonych, w których dochodzi do ekspansji trójek nukleotydowych na chromosomie X (FRAXA, FRAXE, FRAXF). Objawiają się one podobnie do Fra-X, ale z reguły mają łagodniejszy przebieg. Zespoły ekspansji trójek nukleotydowych są efektem zjawiska nieprawidłowej rekombinacji i zauważono, że zachodzą nie tylko u ludzi, ale także u bezkręgowców (muszka owocowa). Dowodzi to, że jest to niedoskonałość systemu replikacji w ogóle, a nie ułomność gatunku ludzkiego. Można zastanawiać się, dlaczego natura nie próbowała udoskonalić mechanizmów rekombinacji tak, by zapobiegać ekspansji trójek. Prawdopodobnie jednak nie byłoby to korzystne, ponieważ z tych samych mechanizmów niehomologicznej rekombinacji korzysta ewolucja w procesie specjacji i adaptacji. Ograniczenie swobody replikacji nie mogło wiec mieć miejsca- chorobotwórcze błędy wpisane są w naturę organizmów żywych i nic na to nie poradzimy. Piśmiennictwo: Strelnikov, V. et al. A simple multiplex FRAXA, FRAXE, and FRAXF PCR assay convenient for wide screening programs. Human Mutations, 1999, 13, 2: 166-169. Petruska, J. et al. Analysis of Strand Slippage in DNA Polymerase Expansions of CAG/CTG Triplet Repeats Associated with Neurodegenerative Disease. J Biol Chem, 1998, 273, 9: 5204-5210. Międzynarodowa Konferencja Naukowo‐Szkoleniowa Państwowej Inspekcji Sanitarnej Państwowa Inspekcja Sanitarna zaprasza na VI Międzynarodową Konferencję Naukowo‐Szkoleniową dotyczącą zdrowia publicznego i współpracy transgranicznej w zapobieganiu chorobom zakaźnym. Konferencja odbędzie się w dniach 18‐20 maja 2015 r. w Ostródzie. Lekarze i diagności laboratoryjni biorący udział w konferencji, otrzymają punkty edukacyjne. Ramowy program konferencji: 1. Żywność – suplementy, zanieczyszczenia chemiczne i mikrobiologiczne, pozostałości leków. 2. Choroby zakaźne – nowe zagrożenia. 3. Wybrane zagadnienia onkologiczne. Pakiet onkologiczny. 4. Odnawialne źródła energii. Wpływ na zdrowie i środowisko. 5. Wymagania sanitarno‐epidemiologiczne w podmiotach wykonujących działalność leczniczą. Szczegółowy program konferencji znajduje się stronie: http://konferencja.sanepid.olsztyn.pl/ Testy aglutynacji latekswej Niezastąpione w nowoczesnej diagnostyce laboratoryjnej Konferencja odbędzie się pod patronatem: Głównego Inspektora Sanitarnego Marka Posobkiewicza Głównego Lekarza Weterynarii Marka Pirsztuka Wojewody Warmińsko‐Mazurskiego Mariana Podziewskiego Udział w konferencji zadeklarowali przedstawiciele służb medycznych i weterynaryjnych Litwy, Rosji, Ukrainy, Białorusi, Czech i Gruzji Organizatorzy konferencji: Wojewódzka Stacja Sanitarno‐Epidemiologiczna w Olsztynie Warmińsko‐Mazurskie Stowarzyszenie Higieny i Zdrowia Publicznego w Olsztynie Powiatowa Stacja Sanitarno‐Epidemiologiczna w Ostródzie Wojewódzki Inspektorat Weterynaryjny w Olsztynie Podstawy cytometrii przepływowej – materiały do nauki Jeżeli chcecie pogłębić Waszą znajomość podstaw cytometrii przepływowej, zapraszamy do przeczytania naszego artykułu oraz obejrzenia kilku bardzo fajnych filmów, które przybliżą Wam podstawy metody oraz analizy danych. Jest to bardzo cenna pomoc przy przygotowaniu do egzaminu czy kolokwium. https://www.youtube.com/watch?v=2P7YsJ0Zkio https://www.youtube.com/watch?v=sfWWxFBltpQ https://www.youtube.com/watch?v=ccR5snuCE80 Ruszają targi Eurolab 2015 Od dzisiaj w Warszawie trwają targi Eurolab 2015 dedykowane branży laboratoryjnej. Targi odbywają się w dn. 18-20 marca 2015 w Centrum Targowo-Kongresowym MT Polska w Warszawie, przy ul. Marsa 56C. Na targach zostanie przedstawiona oferta produktów i rozwiązań, które mają zastosowanie w branży chemicznej, farmaceutycznej, kosmetycznej, elektronicznej, spożywczej, naukach przyrodniczych czy kryminalistyce. Producenci i dystrybutorzy wyposażenia do wszelkiego rodzaju laboratoriów, ośrodków badawczych czy instytucji naukowych zaprezentują meble, sprzęt, instrumenty i artykuły analityczne i laboratoryjne, materiały zużywalne, odczynniki chemiczne i materiały odniesienia. Oferta obejmie także projekty informatyczne i oprogramowanie, odzież ochronną, rozwiązania techniczne i technologie niezbędne do prac badawczo-rozwojowych. Testy aglutynacji latekswej Niezastąpione w nowoczesnej diagnostyce laboratoryjnej Dodatkowo wystawcy będą prowadzili wykłady i szkolenia połączone z prezentacją produktów i urządzeń, co stanowi okazję do poznania ich szczegółowego funkcjonowania. Crimelab Do profesjonalistów zajmujących się na co dzień zagadnieniami związanymi z techniką kryminalistyczną skierowane są specjalistyczne konferencje. Słuchacze dowiedzą się o zmianach wynikających z nowelizacji Kodeksu postępowania karnego, zapoznają się z nowościami w zakresie badania mikrośladów, jak również poszerzą wiedzę na temat zabezpieczania dokumentów i najczęściej pojawiających się fałszerstw. Na szczególną uwagę zasługuje inscenizacja miejsca zdarzenia, podczas której oględzin dokonywać będą technicy kryminalistyczni z Polski i Wielkiej Brytanii. Szkolenia i konferencje Bardzo ważną częścią Targów EuroLab oraz CrimeLab są seminaria i konferencje naukowe, podczas których poruszane są aktualne zagadnienia dla branży analitycznej, pomiarowej i kryminalistycznej. Nad programem merytorycznym czuwa Rada Programowa. Diagności laboratoryjni mogą uzyskać 11 punktów edukacyjnych za udział w 4 bezpłatnych specjalistycznych spotkaniach, które odbędą się pierwszego i drugiego dnia Targów EuroLab. Konferencje te zorganizują: Polskie Towarzystwo Diagnostyki Laboratoryjnej (PTDL), Klub Polskich Laboratoriów Badawczych POLLAB wraz z Polskim Komitetem Normalizacyjnym oraz Komitet Mikrobiologii PAN wspólnie z Polskim Towarzystwem Mikrobiologów. Organizator targów, firma MT Targi Polska, zaprasza do udziału w następujących wydarzeniach: „Akredytacja w obszarach regulowanych. Zasady, uwarunkowania i stan aktualny”, Polskie Centrum Akredytacji; „Automatyzacja, informatyzacja, integracja – medyczne laboratorium diagnostyczne XXI wieku”, „Biologia systemów w medycynie – “omiki” w diagnostyce laboratoryjnej”, Polskie Towarzystwo Diagnostyki Laboratoryjnej; „Problemy laboratoriów”, Klub Polskich Laboratoriów Badawczych POLLAB, Polski Komitet Normalizacyjny; „Zakażenia – problemy terapeutyczne”, Komitet Mikrobiologii PAN, Polskie Towarzystwo Mikrobiologów; „Polska biotechnologia: sukcesy, legislacja, perspektywy w 2015 r.”, Komitet Biotechnologii PAN; „Zdrowie, leki, chemia”, Wydział Chemii Uniwersytetu Warszawskiego, Centrum Nauk Biologiczno-Chemicznych Uniwersytetu Warszawskiego, Komitet Chemii Analitycznej PAN, Polskie Towarzystwo Chemiczne, II Wydział Lekarski, Wydział Farmaceutyczny Warszawskiego Uniwersytetu Medycznego; „Bezmiar widma światłem mierzony”, Główny Urząd Miar; „Świat technik sprzężonych”, Katedra Chemii Analitycznej Wydziału Chemicznego Politechniki Warszawskiej; „Mikrosonda elektronowa i jonowa – nowe kierunki badań mikrochemicznych nie tylko dla geologii”, Państwowy Instytut Geologiczny – PIB; „Miejsce zdarzenia”, Centralne Laboratorium Kryminalistyczne Policji – Instytut Badawczy, Polskie Towarzystwo Kryminalistyczne; „Mikroślady kryminalistyczne w odtwarzaniu przebiegu zdarzenia przestępczego”, Instytut Ekspertyz Sądowych im. Prof. dra Jana Sehna w Krakowie; cykl wykładów Komendy Głównej Straży Granicznej; „Fundusze Europejskie do 2020 roku na badania i rozwój”, Ministerstwo Infrastruktury i Rozwoju, VWR International. Informacje organizacyjne Wstęp na Targi EuroLab oraz CrimeLab jest bezpłatny po dokonaniu obowiązkowej rejestracji. Oba wydarzenia będą otwarte w godzinach 9:00-17:00 w dniach 18 i 19 marca, natomiast 20 marca w godzinach 9:00-15:00. Więcej informacji na stronie: www.targi.eurolab.pl Dojazd Organizator zapewnia udogodnienia w zakresie dojazdu do Centrum TargowoKongresowego. Na targi będzie można dostać się bezpłatnym autobusem targowym z przystanku autobusowego Emilii Plater 01 naprzeciwko Pałacu Kultury i Nauki oraz pociągiem SKM lub Kolei Mazowieckich z dworca Warszawa Śródmieście, Warszawa Wschodnia lub Warszawa Zachodnia. Stacja docelowa Warszawa Gocławek znajduje się w odległości około 700 metrów od Centrum MT Polska. Czas dojazdu pociągiem z centrum Warszawy do stacji docelowej nie powinien przekroczyć 20 minut. Przydatność diagnostyczna elektroforezy białek W ludzkiej krwi znajduje się kilkaset białek, jednak zaledwie 100 z nich zostało scharakteryzowanych pod względem strukturalnym oraz czynnościowym. Poziom białka całkowitego w surowicy krwi waha się w granicach 6,6-8,7 g/dl i może ulegać zmianie w zależności od stanu zdrowia człowieka. Obok wahań ilościowych białka całkowitego mogą występować zmiany w proporcjach poszczególnych białek, czyli tzw. dysproteinemia [2]. Elektroforeza białek surowicy (proteinogram) jest podstawowym badaniem laboratoryjnym umożliwiającym wykrycie dysproteinemii, dając odpowiedzi na często trudne zagadnienia diagnostyczne. Proteinogram pozwala zwykle na uzyskanie 6 frakcji białkowych. Wśród nich znajduje się największa homogenna frakcja albumin oraz pozostałe frakcje reprezentujące globuliny: α-1, α-2, β-1, β-2 oraz γ-globuliny. Poszczególne frakcje składają się z różnych białek specyficznych o zbliżonym ładunku i ruchliwości elektroforetycznej, ale o odmiennej budowie i funkcji biologicznej [1, 4]. Tab. 1. Prawidłowy udział frakcji białkowych w rozdziale elektroforetycznym [3] Stężenia poszczególnych białek we frakcjach mogą ulec zmianie, ale procentowy udział niektórych z nich jest tak niewielki, że nie wpływa to ani na poziom białka całkowitego, ani na zmianę udziału odsetka danej frakcji w elektroforezie. Dlatego poniżej zostaną omówione tylko te, które mają największe znaczenie diagnostyczne. ALBUMINA Albumina (35-52 g/l) jest produkowana w wątrobie i stanowi 2/3 białek osocza. Utrzymuje ciśnienie osmotyczne krwi oraz jest głównym białkiem transportowym, które wiąże nieswoiście związki słabo rozpuszczalne w wodzie (np. kwasy żółciowe, bilirubinę, miedź, wapń). W rozdziale elektroforetycznym albumina umiejscawia się najbliżej katody [2, 3]. Obniżenie frakcji albumin może wynikać ze zwiększonej utraty białka z moczem (np. w zespole nerczycowym) lub z układem pokarmowym (enteropatia wysiękowa). Do hipoalbuminemii dochodzi również w przewlekłym niedożywieniu, oparzeniach, wstrząsie oraz w ciężkiej niewydolności wątroby. Ze względu na dużą pulę rezerwową albuminy w wątrobie, hipoalbuminemia występuje w przypadku znacznego uszkodzenia tego narządu. Synteza albuminy jest hamowana w reakcjach ostrej fazy, w nowotworach, szpiczaku plazmocytowym, zespole Cushinga i chorobie Gravesa-Basedowa [2, 5, 6]. Wzrost frakcji albumin wskazuje na ostre odwodnienie i towarzyszy wzrostowi innych białek [2]. Bisalbuminemia: uwarunkowane genetycznie występowanie dwóch odmian albumin. W niektórych przypadkach może występować przejściowa bisalbuminemia, która wynika ze zdolności albuminy do wiązania np. kwasów żółciowych w ostrym zapaleniu trzustki, bilirubiny w chorobach wątroby lub penicyliny w trakcie terapii wysokimi dawkami tego antybiotyku [4,5]. Analbuminemia: bardzo rzadko występujący, dziedziczny brak frakcji albuminowej (ok. 0,5 g/dl). Pacjenci z analbuminemią mają niskie ciśnienie tętnicze i umiarkowane obrzęki [1, 4]. FRAKCJA α-1-GLOBULIN Orozomukoid, czyli α-1-kwaśna glikoproteina (0,5-1,5 g/l) jest białkiem ostrej fazy, mającym udział w agregacji płytek i rozszerzaniu naczyń krwionośnych. α-1antytrypsyna (0,9-2,0 g/l) stanowi 90% osoczowych α-1-globulin i jest obecna w wielu tkankach, głównie w płucach, gdzie chroni pęcherzyki płucne przed działaniem elastazy granulocytowej [2, 3]. Testy aglutynacji latekswej Niezastąpione w nowoczesnej diagnostyce laboratoryjnej Zmniejszenie frakcji α-1-globulin związane jest głównie z wrodzonym niedoborem α-1-antytrypsyny, który prowadzi do rozwoju rozedmy płuc oraz rzadziej chorób wątroby. Zmniejszenie tej frakcji może być także następstwem niedożywienia lub niewydolności wątroby i zazwyczaj towarzyszy mu spadek innych frakcji [1, 5, 6]. Wzrost frakcji α-1-globulin najczęściej wynika ze wzrostu białek ostrej fazy, takich jak orozomukoid. Poziom orozomukoidu wolno wzrasta do 5 dnia odczynu zapalnego, nie przekraczając 3-krotnie wartości referencyjnej. Największe znaczenie kliniczne przypisuje się temu białku w rozpoznawaniu infekcji bakteryjnych w okresie noworodkowym. Wzrost stężenia orozomukoidu u noworodków w zakresie 6-8 g/l jest wskaźnikiem sepsy. Wzrost frakcji α-1globulin może wynikać również ze znacznego wzrostu α-fetoproteiny (AFP) w nowotworach i u kobiet w ciąży, a także wynikać z podwyższenia stężenia α-1antytrypsyny w chorobie Crohna [1, 3, 5, 6]. FRAKCJA α-2- GLOBULIN Haptoglobina (30-200 mg/dl) jest białkiem ostrej fazy, odpowiedzialnym za wiązanie i transport hemoglobiny oraz miedzi. Ceruloplazmina (20-60 mg/dl) odpowiada za 80% właściwości oksydacyjnych osocza, powodując utlenianie żelaza i umożliwiając jego łączenie z transferryną. α-2-makroglobulina (130-300 mg/dl) stanowi 1/3 białek omawianej frakcji, jej duża masa cząsteczkowa uniemożliwia przechodzenie tego białka poza łożysko naczyniowe. Tyreoglobulina (9,6-18 mg/l) jest białkiem odpowiedzialnym za syntezę i magazynowanie hormonów tarczycy [2, 5]. Zmiany w zakresie frakcji α-2-globulin: Obniżenie frakcji α-2-globulin występuje w przypadku niewydolności wątroby, utraty białka, np. z moczem, a także w wyniku hemolizy wewnątrznaczyniowej. Zmniejszenie się stężenia haptoglobiny jest najczulszym i najbardziej swoistym markerem hemolizy wewnątrznaczyniowej. Na obniżenie frakcji α-2-globulin może mieć również wpływ niedobór ceruloplazminy w chorobie Menkesa i Wilsona (poniżej 150 mg/l) [2, 6]. Ze wzrostem frakcji α-2-globulin mamy do czynienia w stanach zapalnych, co wynika z 15% wzrostu haptoglobiny i ceruloplazminy oraz w zespole nerczycowym, w którym rośnie poziom α-2-makroglobuliny. Wzrost poziomu haptoglobiny może występować również w chłoniaku ziarniczym i w cholestazie, a także u osób leczonych kortykosterydami, natomiast wzrost tyreoglobuliny w nadczynności tarczycy [1,2,6]. Ryc. 1. Ostra faza- podwyższenie frakcji globulin α-1 i α-2. Wzrost tylko frakcji α-1 można obserwować w przewlekłym zapaleniu wątroby i w ostrej fazie, której towarzyszy hemoliza [4]. Ryc. 2. Zespół nerczycowy – obniżenie albumin i frakcji γ w połączeniu ze wzrostem α-2-globulin. Obniżenie stężenia albumin musi być rzędu 1/3 ich prawidłowej wartości, aby było uwidocznione w elektroforezie [4]. Frakcja podwójna może być wynikiem użycia surowicy wykazującej ślady hemolizy lub występującej rzadko nietypowej migracji elektroforetycznej apolipoproteiny B [1,4]. FRAKCJA β-GLOBULIN Frakcja β-1-globulin składa się głównie z transferyny (200-400 mg/dl), która transportuje żelazo do szpiku kostnego. W skład β-2-globulin wchodzą βlipoproteiny, β-2-mikroglobulina, IgA, IgM, czasem IgG oraz białka dopełniacza, z których składnik C3 (90-180 mg/dl) ma największy udział procentowy tej frakcji [2, 3]. Zmiany w zakresie frakcji β-globulin: Obniżenie frakcji β-globulin następuje w wyniku znacznego obniżenia stężenia transferyny, co ma miejsce w niedożywieniu, nowotworach oraz reakcjach ostrej fazy. Spadek tej frakcji może wynikać z obniżenia stężenia C3, co związane jest głównie ze starzeniem się próbki i dezaktywacją dopełniacza, a także w chorobach autoimmunologicznych, np. toczniu rumieniowatym i reumatoidalnym zapaleniu stawów [1, 3, 6]. Wzrost frakcji β-globulin występuje w niedoborze żelaza, czego konsekwencją jest wzrost stężenia transferyny. Wzrost udziału tej frakcji ma miejsce w chorobach wątroby, głównie w marskości. Może być też wynikiem występowania białka monoklonalnego a także wolnych łańcuchów kappa i lambda w przebiegu szpiczaka mnogiego. Wzrost stężenia β-2-mikroglobuliny powyżej 35 mg/l jest negatywnym markerem prognostycznym szpiczaka mnogiego [1, 3, 6]. FRAKCJA γ-GLOBULIN Jest głównym miejscem lokowania się immunoglobulin. Zmiany w zakresie frakcji γ-globulin: Obniżenie frakcji γ-globulin jest stanem fizjologicznym u noworodków. U dorosłych może wynikać z zaburzeń odporności spowodowanych chemio- i radioterapią, leczeniem immunosupresyjnym oraz podawaniem kortykoidów. Jest to również objaw charakterystyczny dla szpiczaka produkującego wolne łańcuchy [1, 4]. Ryc. 3. Hipogammaglobulinemia – wyraźny spadek stężenia γ-globulin [1]. Wzrost frakcji γ-globulin w postaci rozlanego prążka jest typowy dla tzw. gammapatii poliklonalnych obserwowanych w przebiegu przewlekłego zapalenia, a także chorób nowotworowych, AIDS i niektórych chorób o podłożu autoimmunologicznym (np. chorobie Crohna). W niewydolności wątroby występuje gammapatia poliklonalna z charakterystycznym mostkiem gamma-beta między tymi dwoma strefami. Ostry, jednorodny szczyt w rejonie γ-globulin, powodujący zniekształcenie strefy beta i gamma, świadczy o gammapatiach monoklonalnych związanych zazwyczaj z procesem rozrostowym, takim jak makroglobulinemia Waldenstroma, szpiczak mnogi czy pierwotna amyloidoza. Między frakcją beta i gamma lokuje się białko C-reaktywne, dlatego w wyniku wybitnego wzrostu tego białka ostrej fazy może dochodzić do uwidocznienia słabego prążka we frakcji γ-globulin [1, 3, 4]. Ryc. 4. Mostek β-γ – obraz zlania frakcji beta i gamma, charakterystyczny dla marskości wątroby, a także reumatoidalnego zapalenia stawów i przewlekłych stanów zapalnych [1]. Ryc. 5. Gammapatia monoklonalna – ostry, jednorodny szczyt w rejonie γglobulin [1]. Proteinogram białek surowicy dostarcza istotnych informacji o stanie klinicznym pacjenta. Największe znaczenie przypisuje się analizie rozdziału całościowo, z ewentualnym uzupełnieniem o oznaczanie ilościowe poszczególnych białek. Szczególnego opracowania wymaga pojawianie się frakcji białka monoklonalnego oraz obecność białka całkowitego powyżej 8,6 g/dl. Piśmiennictwo: 1. Bobilewicz D. Elektroforeza w praktyce laboratoryjnej. Cz. 1 Rozdział elektroforetyczny białek surowicy. Przegl Med Lab, 2005; 4, 2: 3-6. 2. Bobilewicz D., Jasińska A, Kowalska K. Diagnostyka medyczna. Białka w pytaniach i odpowiedziach. Warszawa, 2010; Roche Diagnostics. 3. Dembińska-Kieć A., Naskalski W. J. Diagnostyka laboratoryjna z elementami biochemii klinicznej. Wrocław, 2005; Elsevier Urban & Partner. 4. Giot J-F. Agarose gel electrophoresis – applications In clinical chemistry. JMB, 2010; 29:9-14. 5. Keren F. D., Protein electrophoresis in clinical diagnosis. 2003; Edward Arnold. 6. O’Connell X. T., Horita J. T., Kasravi B. Understanding and Interpreting Serum Protein Electrophoresis. American Falimy Physician, 2005; 71, 1:105-112. Mikrobiologia serologii i genetyka w Serologia i transfuzjologia to szczególne działy diagnostyki laboratoryjnej. Wykorzystują one wiedzę z zakresu mikrobiologii i genetyki. Wielu z Was zapyta: Co ma wspólnego mikrobiologia i genetyka z serologią? Otóż ma wiele wspólnego. Primum non nocere. Szeroka gama preparatów krwiopochodnych przygotowywana jest w taki sposób, aby nie zaszkodzić biorcy. Odpowiednie testy diagnostyczne pozwalają na wyeliminowanie krwi od dawców zakażonych HIV, HBV, HCV. W przypadku osocza i krioprecypitatu stosuje się karencję. Zabieg ten zmniejsza możliwości przeniesienia zakażeń wirusowych poprzez ich przetoczenie. Karencjonowanie polega na sprawdzeniu wyników wirusologicznych (HIV, WZW typu B, WZW typu C, kiła) u dawcy w dniu pobrania materiału oraz po przynajmniej 16 tygodniach przechowywania składnika krwi. Karencjonowanie ma na celu eliminację tzw.„okienka serologicznego” u dawcy. Niektórzy pacjenci z obniżoną odpornością powinni otrzymać preparaty krwiopochodne nie zawierające CMV. Należą do nich biorcy przeszczepów, pacjenci z ciężkim niedoborem odporności, kobiety ciężarne nie posiadające p/c anty-CMV, wcześniaki o małej wadze urodzeniowej oraz płody. Ze względu na fakt, ze CMV namnaża się wewnątrzkomórkowo, tworząc charakterystyczne wtręty w jądrze i cytoplazmie komórek, ryzyko przeniesienia wirusa podczas przetaczania świeżych składników krwi, zawierających mono- i wielojądrzaste leukocyty, jest bardzo duże Kontrola mikrobiologiczna składników krwi sięga jeszcze głębiej.. Pracownie, w których przygotowywane są składniki krwi, poddawane preparatyce otwartej, są systematycznie kontrolowane pod względem sterylności używanej komory z laminarnym przepływem powietrza. Każdy koncentrat krwinek płytkowych (KKP), podlega kontroli bakteriologicznej, w przypadku, gdy jego czas przechowywania został przedłużony do 7 dni. Jakie infekcje mogą zostać przekazane drogą transfuzji? Potencjalnym niebezpieczeństwem jest HBV, HCV, HIV, HTLV i CMV. Nosicielstwo oraz okres latencji wirusa zwiększają prawdopodobieństwo jego niewykrycia. Dlatego też ciągle udoskonala się testy oraz schematy postępowania diagnostycznego. W Wielkiej Brytanii problemem stał się wariant choroby Creutzfeldta-Jakoba (vCJD). Choroba dotyczy ośrodkowego układu nerwowego. Wywołana jest przez tzw. priony czyli infekcyjne białka, występujące powszechnie w każdym organizmie i całkowicie niegroźne. Dopiero w sytuacji, gdy zmieniają one swoją naturalną konformację, stają się białkiem prionowym infekcyjnym. Białko to jest nierozpuszczalne, zaczyna odkładać się na neuronach i powoduje zaburzenia w pracy układu nerwowego. Priony są zazwyczaj odporne na standardowe warunki sterylizacji, co zwiększa ryzyko zakażenia. Wirus vCJD często nie daje objawów swojej obecności przez wiele lat. Testy wykrywające vCJD są drogie i niespecyficzne. Istnieje potencjalne ryzyko zakażenia poprzez składniki krwi – odnotowano 4 przypadki przeniesienia vCJD [1]. Poszukuje się skutecznego sposobu usuwania infekcyjności prionów we krwi. Teoretycznie można do tego celu wykorzystać leukoredukcję, która jest z powodzeniem stosowana w przypadku obniżania możliwości transmisji CMV, ludzkiego wirusa Tlimfotropowego (HTLV I) oraz wirusa Epsteina-Barra(EBV). Naukowcy jednak nie są zgodni co do wpływu leukoredukcji na vCJD [2]. W Ameryce kilku biorców zostało zakażonych Wirusem Zachodniego Nilu (WNV) drogą transplantacji [3]. W Stanach Zjednoczonych zanotowano ponad 60 możliwych transfuzjologicznych zakażeń WNV, z czego koło 20 potwierdziło się [4]. Kilkanaście przypadków rozwinęło objawy ostrego zapalenia opon mózgowych , kilka zakończyło się zgonem. Wszyscy badani biorcy dali wynik pozytywny w PCR [5]. Dziedziczenie grup krwi W układzie ABO istnieją 4 antygeny: A, A1, B, AB. Różna kombinacja tych antygenów prowadzi do powstania jednej z grup: A, B, AB, O. Antygeny A i B są kontrolowane przez geny trzech oddzielnych loci: ABO, H h, Se se. Allele A, B i O umiejscowione są na długim ramieniu chromosomu 9 w locus ABO. Podczas, gdy gen O jest genem amorficznym, geny A i B kodują swoiste glikozylotransferazy. Antygen A jest wynikiem przyłączenia Nacetylogalaktozaminy do łańcucha H za pomocą swoistej transferazy wytwarzanej przez gen A. Antygen B powstaje poprzez przyłączenie D-galaktozy do łańcucha H dzięki aktywności transferazy produkowanej przez gen B. Białko kodowane przez gen O nie ma aktywności transferazy, stąd też osoby z grupą krwi O posiadają nie przekształcony antygen H. Antygeny układu ABO powstają bardzo wcześnie w życiu płodowym, a zmienna liczba determinant antygenowych może prowadzić do powstania różnych odmian antygenów A i B. Dziedziczenie głównych grup krwi podlega prawom Mendla. W układzie ABO związek między fenotypem a genotypem jest następujący: Fenotyp A – genotyp AA lub AO Fenotyp B – genotyp BB lub BO Fenotyp AB – genotyp AB Fenotyp O- genotyp OO Tabela 1. Dziedziczenie grup krwi w układzie ABO Oprócz układu ABO istotną częścią immunologii transfuzjologicznej jest układ Rh. Antygeny układu Rh kodowane są przez dwie pary genów sprzężonych, leżące na krótkim ramieniu chromosomu 1. Jeden gen koduje polipeptyd RhD, drugi polipeptydy RhCc/Ee i posiada 4 allele: RhCe, Rhce, RhcE, RhCE. Elementem niezbędnym do syntezy układu Rh jest glikoproteina RhAG (chromosom 6). W układzie Rh występowanie genotypu DD oraz Dd wiąże się z Rh+, natomiast genotypu dd z Rh-. Antygen d nie istnieje, ale oznacza brak antygenu D. Genotyp układu Rh można ustalić tylko na podstawie wielopokoleniowych badań rodzinnych. Tabela 2. Dziedziczenie czynnika Rh przez potomstwo Bada się możliwość enzymatycznej konwersji grup in vitro poprzez degradację antygenu A i B [6]. W celu wytwarzania krwi uniwersalnej, prowadzono badania nad konwersją grup A1, A2, B, A1B do grupy O. Do usunięcia antygenów z powierzchni krwinek użyto bakteryjnych glikozydaz [7] oraz rekombinowanej endo-beta-galaktozydazy [8]. Serologia grup krwi wykazuje istotny związek nie tylko z mikrobiologią i genetyką, ale także ze zwiększonym ryzykiem niektórych stanów, w zależności od posiadanej grupy krwi. Testy aglutynacji latekswej Niezastąpione w nowoczesnej diagnostyce laboratoryjnej Osobnicy z grupą krwi O posiadają podwyższone ryzyko rozwoju niektórych infekcji wirusowych [9] oraz zaburzeń krzepnięcia, podczas gdy osobnicy z inną niż O grupą krwi wykazują większą zapadalność na niektóre nowotwory [9, 10, 11 , 12]. Ponadto należy przypomnieć o związku grupy krwi O z malarią. Nie chroni ona przed chorobą, ale liczne badania sugerują, że osoby z grupą krwi O łagodniej przechodzą malarię [13]. Mechanizm infekcyjny Plasmodium opiera się o wnikanieparazyta do krwinek czerwonych, na skutek czego może dojść do tworzenia rozet. Sklejone erytrocyty blokują przepływ krwi i uszkadzają tkanki, co wiąże się z cięższym przebiegiem choroby. Plasmodium wykorzystuje do tworzenia rozet antygeny obecne na powierzchni erytrocytów grup A i B. Erytrocyty osób grupy O, u których ww. antygeny nie występują, tworzą małe rozety, które łatwiej się rozpadają [14]. Na podstawie powyższych obserwacji można wnioskować, że grupa O utrzymuje się w populacji, ponieważ chroni przed malarią. Mikrobiologia i genetyka odgrywają ogromną rolę w serologii i transfuzjologii. Odpowiednio przygotowane preparaty krwiopochodne minimalizują niebezpieczeństwo transferu transfuzjologicznego wielu wirusów, a zaawansowane techniki biologii molekularnej pozwalają na rozwiązanie wielu problemów diagnostycznych. Nasuwa się więc pytanie: Czy w przyszłości metody biologii molekularnej zastąpią serologiczne metody oznaczania grup krwi? Odpowiedź brzmi: TAK, w niektórych krajach, dla niektórych testów, ale nie dla rutynowego oznaczenia ABO, ponieważ antygeny układu ABO są łatwe do oznaczenia metodami serologicznymi, lecz złożone genetycznie. mgr Agnieszka Helis, diagnosta laboratoryjny Piśmiennictwo: 1. Health Protection Report. Fourth case of transfusion-associated variant-CJD infection. News, 2007, 1, 3. 2. Sher GD. Leukoreduction of the blood supply. Canadian Blood Services, 1999. 3. CDC. West Nile Virus Infections in Organ Transplant Recipients. MMWR, 2005; 54: 1-3. 4. Brown R. Transfusion associated West Nile virus infection: implications for Europe. Eurosurveillance, 2003, 7, 34: 2278. 5. de Oliveira AM., Beecham BD., Montgomery SP. et al. West Nile Virus Blood Transfusion-Related Infection Despite Nucleic Acid Testing. Public Health Resources, 2004. 6. Olsson ML., Hill CA., de la Vega H. et al. Universal red blood cells–enzymatic conversion of blood group A and B antigens. Transfus Clin Biol, 2004; 11, 1: 33-39. 7. Liu QP., Sulzenbacher G., Yuan H. et al. Bacterial glycosidases for the production of universal red blood cells. Nat Biotechnol, 2007; 25, 4: 454-464. 8. Kobayashi T., Liu D., Ogawa H. et al. Removal of blood group A/B antigen in organs by ex vivo and in vivo administration of endo-beta-galactosidase (ABase) for ABO-incompatible transplantation. Transpl Immunol, 2009; 20, 3: 132-138. 9. Harris JB., Khan AI., LaRocque RC. Blood Group, Immunity, and Risk of Infection withVibrio cholerae in an Area of Endemicity. Infect Immun, 2005; 73, 11: 7422-7427. 10. Dabelsteen E., Gao S. ABO blood-group antigens in oral cancer. J Dent Res, 2005; 84, 1: 21-28. 11. Wolpin BM. ,Chan AT., Hartge P. et al. ABO Blood Group and the Risk of Pancreatic Cancer. JNCI J Natl Cancer Inst, 2009; 101, 6: 424-431. 12. Tursen U., Tiftik EN., Unal S. et al. Relationship between ABO blood groups and skin cancers. Dermatology Online Journal, 11, 3. 13. Cserti CM., Dzik WH. The ABO blood group system andPlasmodium falciparum malaria. Blood, 2007; 110,7: 2250-2258. 14. Rowe JA., Handel IG., Thera MA. et al. Blood group O protects against severe Plasmodium falciparum malaria through the mechanism of reduced rosetting. PNAS, 2007; 104, 44: 17471–17476. Receptory Toll-podobne oraz helikazy RNA, czyli „molekularne sensory” inwazji wirusowej Na co dzień nikt z nas nie zdaje sobie sprawy, od jak wielu mechanizmów zachodzących w naszych komórkach zależy zdrowie całego organizmu. Oczywiście pokłony bić musimy naszemu niezawodnemu układowi immunologicznemu, dzięki któremu jesteśmy w stanie zwalczyć większość infekcji wirusowych i przeżyć bez większego szwanku zwykłe przeziębienie; lecz aby nasz system odpornościowy zadziałał jak należy, komórki mające kontakt z wirusem muszą w jakiś sposób „poinformować” o obecności intruza. Tym właśnie zajmują się receptory Toll-podobne typu 7/8 oraz 3 (Toll-like receptors, TLRs) oraz specyficzne helikazy RNA: RIG-1 (retinoic acid inducible gene 1) oraz MDA-5 (melanoma differentiation-associated gene 5), które choć działają niezależnie i nieco odmiennie to w efekcie dają ten sam wynik — organizm przygotowuje się na starcie z niepożądanym patogenem. Te dwa sposoby rozpoznawania wirusowego materiału genetycznego już od kilku lat cieszą się dużym zainteresowaniem wśród naukowców — wykazano, że są wspólne dla wszystkich komórek eukariotycznych i rozróżniane są głównie poprzez subkomórkową lokalizację białek kluczowych dla tych mechanizmów. Receptory Toll-podobne typu 7/8 i 3 wchodzą w skład białek błony komórkowej i endosomalnej, natomiast helikazy RIG-1 oraz MDA-5 występują w przestrzeni cytoplazmatycznej. Białka te są odpowiedzialne za wykrywanie oraz wiązanie dwuniciowego RNA (double stranded RNA, dsRNA), co inicjuje kaskadę sygnałową prowadzącą do sekrecji szeregu cytokin prozapalnych, w tym interferonów (IFNs). Inicjowanie podobnej odpowiedzi immunologicznej nie oznacza jednak, że molekuły te działają identycznie — poszczególne receptory posiadają „ulubiony” wzór rozpoznawania patogenu wirusowego: RIG-1 preferencyjnie rozpoznaje krótkie (poniżej 1kb) dsRNA z grupą fosforanową na 5’ końcu, za to MDA-5 najczęściej wykrywa długie cząsteczki (1-5 kb). Synteza dsRNA w zakażonych komórkach jest konieczna do replikacji wirusów o materiale genetycznym w postaci pojedynczej nici kwasu rybonukleinowego (single stranded RNA, ssRNA), dzięki czemu takie wirusowe dsRNA może być rozpoznane przez komórkę jako obce. W istocie, stanowi ono jedno z ważniejszych wirusowych „wzorów” należących do grupy czynników określanych jako PAMPs (ang. patogen associated molecular patterns). Badania nad konkretnymi wirusami wykazały, że białko RIG-1 jest odpowiedzialne za detekcję m.in. wirusa grypy, wirusa RS (ang. respiratory syncytial virus, RSV) oraz niektórych paramyksowirusów, a więc patogenów posiadających jednoniciowe RNA o ujemnej polarności — ss(-) RNA, natomiast MDA-5 uczestniczy w rozpoznaniu szeregu pikornawirusów — mikrobów, których materiał genetyczny stanowi jednoniciowe RNA o dodatniej polarności — ss(+) RNA. Pomimo tych różnic, obydwie helikazy przekazują sygnał w ten sam sposób – poprzez swoje domeny CARD (ang. caspase recruitment domains) do zlokalizowanego na zewnętrznej błonie mitochondrialnej białka MAVS (ang. mitochondria antiviral signaling protein), który następnie umożliwia aktywację kinaz TBK-1 (ang. TANK binding kinase 1) oraz kinazy IκB, prowadząc do zaktywowania czynników transkrypcyjnych IRF3 (ang. interferon regulatory factor 3) oraz NFκB (ang. nuclear factor kappa-light-chain-enhancer of activated B cells). Cała ta kaskada sygnału ma na celu pobudzenie komórek do wydzielania interferonów typu I (głównie α i β). Receptory Toll-podobne, z kolei, rozpoznają zarówno dwuniciowe (TLR3), jak i jednoniciowe RNA (TLR7/8). Ich działanie uzależnione jest od kilku białek pośredniczących, wśród których najważniejsze są dwa adaptory: MyD88 (ang. myeloid differentiation primary response protein) oraz TRAF6 (ang. TNF receptorassociated factor 6), dzięki którym możliwe jest przekazanie sygnału do jądra komórkowego, w których zachodzi aktywacja czynnika transkrypcyjnego NFκB — kluczowego pośrednika w uruchomieniu transkrypcji genów szeregu prozapalnych białek. Wszystkie te reakcje mają na celu rozwój procesu zapalenia, któremu jak wszyscy wiedzą zwykle towarzyszy ból, lokalny obrzęk i zaczerwienienie. Objawy te są wynikiem zmian zachodzących w naczyniach krwionośnych — rozszerzenie ścian powoduje uczucie gorąca, komórki śródbłonka wykazując ekspresję cząsteczek adhezyjnych promują wiązanie się leukocytów, które następnie migrują do przylegających tkanek, a zwiększenie przepuszczalności powoduje przeciek płynów i białek z krwi oraz ich akumulację, co powoduje uczucie bólu. To jednak dopiero początek zmian, jakich doświadczają nasze tkanki podczas infekcji wirusowej, a do całkowitego zwalczenia choroby potrzebne jest współgranie wielu typów komórek układu immunologicznego. Receptory TLR3 i TLR7/8, jak również RNA-specyficzne helikazy RIG-1 i MDA-5 określane są mianem receptorów rozpoznających wzorzec — w skrócie PRRs (pattern recognition receptors) i stanowią pierwszą linię obrony przez rozprzestrzenianiem się infekcji wirusowej. Są one obecnie przedmiotem intensywnych badań mikrobiologów oraz immunologów, a przyszłe lata mogą przynieść nowe dane odnośnie ich interakcji z ludzkimi patogenami wirusowymi. AM Testy aglutynacji latekswej Niezastąpione w nowoczesnej diagnostyce laboratoryjnej Piśmiennictwo: Slater L., Bartlett NW., Haas JJ. et al. Co-ordinated Role of TLR3, RIG-I and MDA5 in the Innate Response to Rhinovirus in Bronchial Epithelium. PLoS Pathog, 2010; 6, 11: e1001178. Flür K., Allam R., Zecher D. et al. Viral RNA induces type I interferon-dependent cytokine release and cell death in mesangial cells via melanoma-differentiationassociated gene-5: Implications for viral infection-associated glomerulonephritis. Am J Pathol, 2009; 175, 5: 2014-2022. Takeuchi O., Akira S. Innate immunity to virus infection. Immunol Rev, 2009; 227, 1: 75-86. Schlee M., Barchet W., Hornung V. et al. Beyond double-stranded RNA-type I IFN induction by 3pRNA and other viral nucleic acids. Curr Top Microbiol Immunol. 2007; 316: 207-230. Kawai T., Akira S. Antiviral signaling through pattern recognition receptors. J Biochem, 2007; 141, 2: 137-145. Ishii KJ., Coban C., Kato H. et al. A Toll-like receptor-independent antiviral response induced by double-stranded B-form DNA. Nat Immunol, 2006; 7, 1: 40-48.