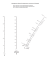Opis ćwiczenia - Wydział Chemii UJ
Transkrypt
Opis ćwiczenia - Wydział Chemii UJ
Wydział Chemii UJ, kierunek Chemia medyczna Podstawy Chemii – Laboratorium Rozdzielanie substancji – Przepisy ĆWICZENIA PRZEPROWADZANE W FORMIE POKAZÓW: 1. Rozdzielanie w układzie ciało stałe/ciało stałe. Sublimacja. Sublimacja stałego jodu z jego mieszaniny z piaskiem. Odczynniki i przybory laboratoryjne: elektryczna płyta grzewcza zanieczyszczony jod, zlewka, kolba okrągłodenna, Wykonanie ćwiczenia: Ze względu na trujące działanie par jodu doświadczenie należy wykonać pod wyciągiem. W suchej czystej zlewce o pojemności ok. 100 cm3 umieścić ~1 g zanieczyszczonego jodu. Zlewkę z preparatem przykryć kolbą okrągłodenną napełnioną w 3/4 zimną wodą. Zlewkę umieścić na gorącej płycie grzewczej aż do pojawienia się fioletowych par sublimującego jodu. Zmniejszyć temperaturę płyty grzewczej i przeprowadzić sublimację do końca. Po ochłodzeniu zlewki (brak fioletowych par) zebrać ostrożnie czysty jod z powierzchni kolby. Tak otrzymany preparat zawiera jeszcze lotne zanieczyszczenia (głównie zaokludowany Cl2). 2. Rozdzielanie w układzie ciecz/ciecz. Destylacja frakcjonowana. Destylacja wody z wodnego roztworu chlorku miedzi(II) (CuCl2) Destylacja jest powszechnie stosowaną metodą rozdzielania mieszających się ze sobą cieczy. Przeprowadza się ją w specjalnie przygotowanym zestawie (kolba okrągłodenna, chłodnica, odbieralnik) przedstawionym na Rysunku 1. Ciecz, którą chcemy rozdzielić przez destylację umieszcza się w kolbie (A) zaopatrzonej w tubus boczny i termometr (D) osadzony w korku. Objętość cieczy nie powinna przekraczać połowy pojemności kolby. Zbiornik z alkoholem termometru powinien się znajdować nieco poniżej tubusa bocznego. Tak umieszczony termometr wskazuje temperaturę wrzenia składnika. Do kolby należy wrzucić kamyczki wrzenne (koraliki szklane lub kawałki niepolerowanej porcelany), których obecność zapobiega przegrzaniu cieczy. W czasie wrzenia, pary cieczy kierowane są do chłodnicy (B) przez tubus boczny kolby. W zależności od temperatury wrzenia destylowanej cieczy stosuje się chłodnice z chłodzącym płaszczem wodnym - chłodnice Liebiega (temp. wrzenia poniżej 120 °C) lub bez płaszcza chłodzącego - odpowiednio długa rurka szklana (temp. wrzenia powyżej 150 °C). W chłodnicy Liebiega strumień chłodzącej wody płynie w kierunku przeciwnym do kierunku ruchu par destylowanej substancji. W przypadku cieczy o niskich temperaturach wrzenia stosuje się chłodnice kulkowe, w których powierzchnia kontaktu par jest znacznie większa niż w poprzednio omówionych typach chłodnic. Pary destylatu ulegają skropleniu w chłodnicy a ciecz spływa do odbieralnika (C). Destylację można prowadzić pod ciśnieniem atmosferycznym lub pod zmniejszonym ciśnieniem. W przypadku konieczności rozdzielenia mieszaniny kilku cieczy różniących się temperaturami wrzenia i nie tworzących azeotropu stosuje się destylację frakcjonowaną. W tym celu w odbieralniku (C) zbiera się najpierw ciecz o najniższej temperaturze wrzenia, a proces oddestylowania tego składnika obserwuje się poprzez sprawdzanie temperatury (pozostaje Strona 1 z 4 Wydział Chemii UJ, kierunek Chemia medyczna Podstawy Chemii – Laboratorium Rozdzielanie substancji – Przepisy stała) na termometrze (D). Gdy temperatura zacznie się podnosić, odbieralnik należy zmienić na nowy, w którym zostanie zgromadzony następny składnik wrzący w wyższej temperaturze. Taki sposób postępowania stosuje się aż do całkowitego rozdzielenia mieszaniny. W ramach pokazu na laboratorium prowadzi się pod ciśnieniem atmosferycznym destylację wodnego roztworu chlorku miedzi(II). Do chłodzenia używa się chłodnicy Liebiega. Rysunek 1: Schemat do destylacji cieczy wykorzystywany w ramach pokazu podczas kursu podstawy chemii - laboratorium. Kolba zaopatrzona w tubus boczny (A), chłodnica Liebiega (B), odbieralnik (C) oraz termometr (D). 3. Rozdzielanie w układzie ciecz – ciecz. Ekstrakcja. Ekstrakcja barwników roślinnych metodą ciągłą w aparacie Soxhleta. Odczynniki i przybory laboratoryjne: zielone części roślin (liście lub łodygi), etanol, aparat Soxhleta, płaszcz grzewczy Wykonanie ćwiczenia: Okrągłodenną kolbę o pojemności 10-25 cm3 aparatu Soxhleta (Rysunek 2) napełnić etanolem do 2/3 objętości (do kolby należy wrzucić kamyczki wrzenne). Gilzę wypełnić drobno pokrojonymi liśćmi dowolnej rośliny zielonej (liście świeże lub wysuszone) i umieścić w aparacie Soxhleta. Ćwiczenie można również przeprowadzić bez użycia gilzy. Włączyć przepływ wody w chłodnicy pamiętając, że ma ona wpływać do chłodnicy od dołu. Za pomocą specjalnego elektrycznego płaszcza grzejnego włączyć ogrzewanie kolby. Uwaga! Kolby z etanolem nie wolno ogrzewać płomieniem palnika. Ogrzewany etanol zaczyna wrzeć a jego pary po skropleniu w chłodnicy trafiają do komory z materiałem roślinnym – rozpoczyna się ekstrakcja chlorofilu. Gdy poziom alkoholu osiąga Strona 2 z 4 Wydział Chemii UJ, kierunek Chemia medyczna Podstawy Chemii – Laboratorium Rozdzielanie substancji – Przepisy wysokość bocznej rurki zostaje on przeciągnięty przez syfon na powrót do kolby okrągłodennej. Jest to pierwszy cykl ekstrakcji ciągłej. Można ją wielokrotnie powtarzać, aż do całkowitego usunięcia chlorofilu z rośliny. Fakt ten objawi się odbarwieniem liści, natomiast etanol będzie miał barwę zieloną. Rysunek 2: Schemat aparatu Soxhleta. Strona 3 z 4 Wydział Chemii UJ, kierunek Chemia medyczna Podstawy Chemii – Laboratorium Rozdzielanie substancji – Przepisy ĆWICZENIA DO SAMODZIELNEGO WYKONANIA: 4. Chromatografia cienkowarstwowa Wykrywanie witaminy C (kwasu askorbinowego) w soku chromatografii cienkowarstwowej na żelu krzemionkowym (TLC). z cytryny metodą Odczynniki, materiały i sprzęt: płytki do chromatografii cienkowarstwowej (folia aluminiowa pokryta warstwą żelu krzemionkowego), układ rozwijający (eluent – mieszanina rozpuszczalników), roztwór wzorcowy kwasu askorbinowego (0,01 mol/dm3), świeży sok wyciśnięty z cytryny, jod krystaliczny, kapilara do nanoszenia roztworów na płytki, dwa zakręcane słoiki, pęseta, linijka, miękki ołówek. Wykonanie: Uwagi: Warstwy żelu krzemionkowego (białej strony płytki) nie wolno dotykać palcami; wszystkie czynności na płytkach (nanoszenie roztworów, oznaczanie) wykonywać delikatnie, tak aby nie uszkodzić adsorbenta. Komory chromatograficzne należy otwierać na krótko i chronić przed zmianami temperatury, słońcem i ruchem powietrza. Pary jodu są szkodliwe wszystkie czynności z jodem należy wykonywać pod wyciągiem. Na środku szerokości płytki TLC, w odległości ok. 1,5 cm od krótszego brzegu nanieść za pomocą kapilary (przez delikatne dotknięcie końcem napełnionej roztworem kapilary do płytki) roztwór wzorcowy kwasu askorbinowego, tak aby utworzył plamkę o średnicy 4-6 mm. Zaznaczyć ołówkiem wysokość naniesienia roztworu na brzegu płytki. Wysuszyć płytkę przez pozostawienie na powietrzu na 15 min. (lub suszarką do włosów). Suchą płytkę wstawić do słoika z układem rozwijającym, miejscem naniesienia roztworu badanego do dołu. Po rozwinięciu chromatogramu, kiedy czoło eluentu osiągnie wysokość ok. 1-2 cm poniżej górnego brzegu płytki (ok. 15-20 min), wyjąć płytkę ze słoika, zaznaczyć delikatnie ołówkiem czoło fazy ruchomej (granicę między mokrą, a suchą częścią płytki) i odparować pod dygestorium składniki fazy ruchomej do zaniku zapachu kwasu octowego. Następnie wstawić płytkę do słoika z kilkoma kryształkami jodu. Po pojawieniu się na płytce brązowej plamki wyjąć płytkę ze słoika za pomocą pęsety i położyć na ręczniku papierowym. Obrysować miękkim ołówkiem widoczną plamkę i zaznaczyć punkt na jej środku. Zmierzyć odległości: a) od punktu naniesienia do środka barwnej plamki; b) od punktu naniesienia do czoła fazy ruchomej. Obliczyć współczynnik Rf (retardation factor). Powyższe czynności powtórzyć nanosząc na płytkę klarowny, świeżo wyciśniety sok z cytryny. Po wywołaniu chromatogramu w parach jodu obrysować wszystkie widoczne plamki, zaznaczyć ich środki i obliczyć wartości Rf. Ponieważ po desorpcji jodu plamki nie będą widoczne, należy wykonać rysunki płytek w skali 1:1 lub zdjęcia z położoną obok linijką. Następnie umieścić płytki pod wyciągiem w celu przeprowadzenia desorpcji jodu. Strona 4 z 4