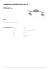αi = ni/n βi = Vi/V αi = βi γi = mi/m
Transkrypt
αi = ni/n βi = Vi/V αi = βi γi = mi/m
Ćwiczenie nr 2 Stechiometria reakcji zgazowania A. Część pierwsza: powtórzenie – koncentracje i stężenia 1. Stężenie Stężenie jest stosunkiem ilości substancji rozpuszczonej do całkowitej ilości rozpuszczalnika. Sposoby wyrażenia stężenia: a) Stężenie molowe (ułamek molowy) αi jest to stosunek liczby moli jednego składnika ni do sumy liczby moli w roztworze n: αi = ni/n ni – liczba moli i-tej substancji, n – całkowita liczba moli, n = n1 + n2 + n3 + ... nN, α1 + α2 + α3 + ... αN = 1 Stężenie αi przyjmuje wartości z przedziału: 0 − 1. b) Stężenie objętościowe (ułamek objętościowy) β jest to stosunek objętości jednego składnika Vi do objętości roztworu V: βi = Vi/V Vi – objętość i-tej substancji, V – całkowita objętość, β1 + β2 + β3 + ... βN = 1 V = V1 + V2 + V3 + ... , Stężenie βi przyjmuje wartości z przedziału: 0 − 1. Uwaga: ze względu na fakt, że objętość mola gazów w tych samych warunkach jest równa, molowe i objętościowe stężenia są równe: αi = βi c) Stężenie masowe (ułamek masowy) γi jest to stosunek masy jednego składnika mi do masy roztworu m : γi = mi/m 1 mi – masa i-tej substancji, m – masa całkowita, γ1 + γ2 + γ3 + ... γN = 1 m = m1 + m2 + m3 + ... mN, Stężenie przyjmuje γi wartości z przedziału: 0 − 1. Uwaga: zwykle stężenie masowe jest różne od stężenia molowego γi ≠ αi. d) Stężenie procentowe, np. masowe, (procent masowy) εi jest to stosunek masy jednego składnika mi do masy roztworu m pomnożony przez 100%: εi = mi/m∗100% 2. Ciśnienie parcjalne (cząstkowe) Ciśnienie parcjalne pi składnika roztworu jest to ciśnienie, które wywierał by ten pojedynczy składnik, gdyby w danej temperaturze zajmował taką samą objętość, co mieszanina. a) Prawo Daltona: Całkowite ciśnienie mieszaniny gazów p jest równe sumie ciśnień parcjalnych jej składników pi . n p = ∑ pi i =1 b) Ciśnienie parcjalne i-tego składnika obliczamy jako iloczyn całkowitego ciśnienia mieszaniny i udziału molowego (objętościowego) tego składnika pi = α i ∗ p lub pi = β i ∗ p Zadania dla studentów: 1. Obliczyć ciśnienia parcjalne poszczególnych składników suchego powietrza . Przyjąć: O2 = 21%, N2 = 78%, (Ar + inne)= 1%, p=101,3kPa 2. Gaz postały w wyniku zgazowania węgla ma skład jak poniżej: H2 = 29%, CO = 57%, CO2 = 12,5%, N2 = 1,5% Obliczyć ciśnienie parcjalne składników palnych , jeżeli gaz znajduje się pod ciśnieniem p = 0,5 MPa. 2 3. Koncentracja Koncentracja jest stosunkiem liczby moli (masy) substancji rozpuszczanej do objętości lub masy rozpuszczalnika. a) Koncentracja molowa Ai jest to liczba n moli (kmoli) i-tego składnika w 1 dm3 (1 m3) rozpuszczalnika: Ai = n/V = liczba moli w 1 dm3 Wymiar: mol/dm3, kg/m3. Uwaga: objętość V może mieć znaczenie – objętość przestrzeni, objętość gazu. b) Koncentracja masowa pyłu M jest to liczba gramów (kg) masy pyłu w 1 dm3 (1 m3) objętości: M = mpyłu/V = liczba gramów pyłu w 1 dm3 Wymiar: g/m3, kg/m3. Uwaga: objętość V może mieć znaczenie – objętość przestrzeni, objętość gazu. Zadania dla studentów: 1. Obliczyć ile moli tlenu znajduje się w 1 m3 powietrza (O2 = 21%). 2. Znając koncentrację popiołu lotnego w spalinach (np. γ = 120 mg/m3n) i strumień objętości spalin z kotła V = 800 tys. m3/h (T = 150 °C), obliczyć emisje pyłu do atmosfery w kg/h. B. Część druga: stechiometria reakcji utleniania i zgazowania paliw 1. Określić współczynniki stechiometryczne produktów produkty reakcji a. Paliw kopalnych (węglowodory) CxHy + nH2O + mO2 = aH2 + bCO + cH2O Przykład 4CH4 + 2H2O + 3O2 = 4H2 + 4CO + 6H2O 3 (Hydrocarbon) (Water) (Hydrogen) (Oxygen) b. Biomasy (węglowodanów) CxHyOz + nH2O + mO2 = aH2 + bCO + cH2O 2. Sposób rozwiązania I. Zmienne: a) Wiadome: x, y, z, n, m b) Niewiadome: a, b, c II. Algorytm: a) Utworzyć układ równań bilansując pierwiastki: C, H, O C: x=b H: y + 2n = 2a + 2c O: z + n + 2m = b + c b) rozwiązać układ równań ze względu na: a, b, c 3. Obliczyć udziały stężenia molowe produktów reakcji αH2, αCO, αH2O i ich ciśnienia parcjalne pH2, pCO, pH2O CxHyOz + nH2O + mO2 = aH2 + bCO + cH2O Całkowita liczba moli równa się: αΣ = a + b + c αH2 = a/αΣ = a/(a + b + c), αCO = b/αΣ, αH2O = c/αΣ Ciśnienia parcjalne: pH2 = αH2∗p, pCO = αCO∗p, pH2O = αH2O∗p gdzie p [Pa] jest ciśnieniem w układzie. 4 Przykład: niezupełne utlenianie metanu CH4 + 1,5O2 + 5,64N2 → CO + 2H2O + 5,64N2 (Powietrze: 79% N2 + 21% O2) Stężenia składników produktów utleniania Il. moli spalin: αΣ = 1mol CO + 2mole H2O + 5,64 moli N2 = 8,64 moli Udział CO w spalinach: αCO = 1mol CO/8,64 = Udział wody w spalinach: αH2O = 2mole H2O/8,64 = Udział azotu w spalinach: 5,64 mole N2/8,64 = 0,116 0,231 0,653. Ciśnienia parcjalne Ciśnienie całkowite: p = 1000 hPa (h = 102) = 105 Pa pCO = αCO∗p = αCO∗105 Pa = 11,6 kPa, pH2O = αH2O∗105 Pa = 23,1 kPa, pN2 = αN2∗105 Pa = 65,3 kPa, Dodatek: przykładowe dane z analizy elementarnej wybranych paliw stałych (d, mas.) Cd Hd Od Nd Sd Ad Węgiel kam. 74,2 4,7 11,2 1,2 0,5 8,2 Węgiel brun. 64,2 6,4 20,4 1,1 0,6 7,3 Drewno 49,1 5,9 41,2 0,2 0,1 3,5 Słoma 48,5 5,5 39,1 0,3 0,1 6,5 Papier 39,3 5,5 39,3 0,1 0,3 15,5 Paliwo M.J. Sienko, R. A. Plane, Chemia: podstawy i zastosowania, WT, W-wa, 1999. J. Szargut, Termodynamika Techniczna, PWN, W-wa, 1991. Tablice cieplne (dowolne) 5