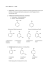Ćwiczenie nr 7
Transkrypt
Ćwiczenie nr 7
Instytut Ochrony Środowiska Państwowa Wyższa Szkoła Zawodowa im. H. Cegielskiego w Gnieźnie ĆWICZENIE 4 OZNACZANIE FENOLU METODĄ BROMIANOMETRYCZNĄ I JODOMETRYCZNĄ DZIAŁ: Redoksymetria ZAGADNIENIA Kiedy mamy do czynienia z reakcją red-oks? Sprzężona para utleniacz-reduktor. Co jest utleniaczem lub reduktorem? Przykłady Amfotery red-oks Wzór Nernsta Elektroda wodorowa Szereg elektrochemiczny metali Bilans elektronowy reakcji red-oks Wpływ pH na potencjał reakcji red-oks Znajomość reakcji przebiegających w roztoworze podczas redoksymetrycznego oznaczania, tlenu, wapnia i fenolu. LITERATURA [1] A. Cygański, Chemiczne metody analizy ilościowej, WNT W-wa1999. [2] J. Minczewski, Z. Marczenko, Chemia analityczna 2 Chemiczne metody analizy ilościowej, Wyd. Naukowe PWN W-wa 2004. I. WSTĘP I CEL ĆWICZENIA FENOL, Nazwa wg IUPAC: phenol, Wzór chemiczny: C6H5OH Nazwa i synonimy: polskie: fenol, hydroksybenzen, kwas karbolowy angielskie: phenol, hydroxybenzene, phenic acid niemieckie: Phenol, Phenylsäure, Karbolsäure, Benzolphenol francuskie: phénol, acide phénique, acide carbolique, benzénol rosyjskie: фенол, гидроксибензол, карболовая кислота Ćwiczenia laboratoryjne z chemii analitycznej i instrumentalnej; oprac.; prowadzący: dr Agnieszka Matłoka Strona 1 Instytut Ochrony Środowiska Państwowa Wyższa Szkoła Zawodowa im. H. Cegielskiego w Gnieźnie Substancja toksyczna oraz żrąca. Działa toksycznie w kontakcie ze skórą i po połknięciu. Powoduje oparzenia. Toksyczne, i żrące, palne ciało stałe. Pary tworzą mieszaniny wybuchowe z powietrzem. Są cięższe od powietrza, gromadzą się przy powierzchni ziemi oraz w dolnych częściach pomieszczeń. Stężenia oraz dawki śmiertelne i toksyczne Próg wyczuwalności zapachu – 0,2-20 mg/m3 LD50 (szczur, doustnie) – 384 mg/kg LC50 (szczur, inhalacja) – 316 mg/m3 LD50 (królik, skóra) – 850 mg/kg Wartości graniczne wskaźników jakości wody w klasach wód powierzchniowych: fenole (indeks fenolowy) I klasa czystości – 0,001 mg/l pH = 6,5 ÷ 8,5 II klasa czystości – 0,005 mg/l pH = 6,0 ÷ 8,5 III klasa czystości – 0,01 mg/l pH = 6,0 ÷ 9,0 IV klasa czystości – 0,05 mg/l pH = 5,5 ÷ 9,0 V klasa czystości > 0,05 mg/l pH < 5,5 lub > 9,0 Najwyższe dopuszczalne wartości wskaźników zanieczyszczeń dla oczyszczonych ścieków przemysłowych: fenole lotne (indeks fenolowy) – 0,1 mg/l (dla wszystkich sektorów i rodzajów ścieków)* *Rozporządzenie Ministra Środowiska z dnia 8 lipca 2004 r. w sprawie warunków, jakie należy spełnić przy wprowadzaniu ścieków do wód lub do ziemi, oraz w sprawie substancji szczególnie szkodliwych dla środowiska wodnego (DzU 2004, nr 168, poz. 1763). Jeżeli do zakwaszonego roztworu fenolu zawierającego jony bromkowe wprowadzi się bromian potasowy w nadmiarze w stosunku do fenolu, wówczas wytworzony w równoważnej ilości do bromianu wolny brom KBrO3 + 5KBr + 6HCl → 3Br2 + 6KCl + 3H2O BrO3- + 5 Br- + 6 H+ = 3 Br2 + 3 H2O bromuje fenol zgodnie z równaniem: C6H5OH + 3 Br2 = C6H2Br3OH + 3 HBr Po dodaniu do roztworu jodku potasowego, nie zużyty w reakcji bromowania brom powoduje wydzielenie równoważnej ilości jodu: 2KI + Br2 → 2KBr + I2 2 I- + Br2 = 2 Br- + I2 Ćwiczenia laboratoryjne z chemii analitycznej i instrumentalnej; oprac.; prowadzący: dr Agnieszka Matłoka Strona 2 Instytut Ochrony Środowiska Państwowa Wyższa Szkoła Zawodowa im. H. Cegielskiego w Gnieźnie Wydzielony jod odmiareczkowuje się mianowanym roztworem tiosiarcznu sodu w obecności skrobi do odbarwienia roztworu: I2 + 2Na2S2O3 → 2NaI + Na2S4O6 I2 + 2 S2O32- = 2 I- + S4O6 2W tiosiarczanie jeden atom siarki występuje na stopniu utlenienia -2, a drugi +6. Oddanie dwóch elektronów przez dwa łączące się ze sobą atomy siarki na stopniu utlenienia -2 widać wyraźnie gdy reakcje zapisze się stosując wzory elektronowe: S2O32- + S2O32- → S4O6 2- + 2e Rycina z książki: A. Cygański Chemiczne metody analizy ilościowej, WNT, wydanie piąte rozszerzone, 1999, Warszawa UWAGA: fenol jest związkiem toksycznym, jego roztwór należy wciągać do pipety tylko przy pomocy gruszki lub innego urządzenia zasysającego! Celem analizy jest oznaczenie zawartości fenolu w otrzymanej próbce wody i porównaniu z zawartymi dopuszczalnymi dawkami zawartymi w literaturze dla wód powierzchniowych. II. SPRZĘT I ODCZYNNIKI: - pipeta poj. 25 ml kolba miarowa poj. 100 ml 2M HCl KBr stały 0,1 N KBrO3 KI stały 0,1 N Na2S2O3 r. skrobia biureta poj.50ml ze statywem Ćwiczenia laboratoryjne z chemii analitycznej i instrumentalnej; oprac.; prowadzący: dr Agnieszka Matłoka Strona 3 Instytut Ochrony Środowiska Państwowa Wyższa Szkoła Zawodowa im. H. Cegielskiego w Gnieźnie - erlenmayerka poj.100ml lub 50ml tryskawka bibuła III. METODYKA: Badany roztwór uzupełnić wodą destylowaną do kreski. Odmierzyć pipetą 10 ml tego roztworu do erlenmayerki i rozcieńczyć do ok. 50ml. Dodać dokładnie /pipeta/ 25 ml 0,1 N roztworu bromianu potasu, ok. 0,5 g bromku potasu i 15 ml 2 molowego HCl. Zamknąć naczynie, zamieszać zawartość i odstawić na 10 min w ciemne miejsce. Następnie dodać ok. 2 g jodku potasu, zamieszać i odmiareczkować wydzielony jod mianowanym roztworem 0,1 N tiosiarczanu sodu. Kiedy roztwór będzie jasnożółty dodać kilka kropli skrobi i kontynuować miareczkowanie do odbarwienia roztworu. Oznaczoną pośrednio zawartość fenolu (w gramach) obliczyć stechiometrycznie oraz wg wzoru: m = [ 25 0,1 - v c ] 0,01567 10 v - objętość roztworu tiosiarczanu [ml]; c - stężenie normalne roztworu tiosiarczanu; 0,01567 – masa 1/6 milimola fenolu [g/mmol] IV. WNIOSKI Sformułować wnioski na podstawie wyników z przeprowadzonego doświadczenia i porównać z dopuszczalnymi normami zawartości fenolu w wodach powierzchniowych (jeziorach) podstawie źródeł zawartych w literaturze. Ćwiczenia laboratoryjne z chemii analitycznej i instrumentalnej; oprac.; prowadzący: dr Agnieszka Matłoka Strona 4 Instytut Ochrony Środowiska Państwowa Wyższa Szkoła Zawodowa im. H. Cegielskiego w Gnieźnie Ćwiczenia laboratoryjne z chemii analitycznej i instrumentalnej; oprac.; prowadzący: dr Agnieszka Matłoka Strona 5