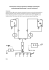Pobierz opis
Transkrypt
Pobierz opis
Joanna Dominika Kozak [email protected] Uniwersytet Medyczny w Lublinie, Wydział Farmaceutyczny „Badania in vitro aktywności biologicznej wybranych substancji jako allosterycznych inhibitorów neuronalnych receptorów nikotynowych” Problem uzależnienia od nikotyny dotyka znaczną część populacji ludzkiej. Każdego roku ponad pięć milionów ludzi na całym świecie umiera z powodu konsekwencji uzależnienia nikotynowego objawiającego się głównie w postaci nowotworów płuc. Ogromne zyski koncernów ze sprzedaży wyrobów nikotynowych nie są w stanie pokryć rosnących kosztów leczenia osób uzależnionych, a tym bardziej zrekompensować wartości najwyższej jaką jest utrata zdrowia i życia. Dlatego też uwaga i wysiłek wielu naukowców na świecie, w tym także zespołu badawczego w którym mam przyjemność pracować, skupione są na opracowywaniu coraz to lepszych środków leczniczych ułatwiających uzależnionym zerwanie z nałogiem. W naszym laboratorium prowadzony jest projekt (we współpracy z renomowanym National Institute on Aging z Baltimore, USA) opracowania nowej substancji, częściowego antagonisty neuronalnych receptorów nikotynowych o potencjalnym zastosowaniu jako środek przeciw uzależniający. Celem realizowanego przeze mnie projektu badawczego jest ocena aktywności pochodnych dekstrometorfanu przy użyciu elektrofizjologicznej techniki patch - clamp wobec podtypu receptora nikotynowego α3β4 [Rys 1]. Ponadto zostanie sprawdzone czy wprowadzone modyfikacje chemiczne wpłynęły na selektywność tych związków wobec innych podtypów receptorów. Kolejnym celem prowadzonego projektu jest zoptymalizowanie techniki patch – clamp tak aby można było dzięki niej w bardzo dokładny sposób badać aktywności różnych substancji chemicznych wobec szerokiego spektrum receptorów bramkowanych ligandem. Badania takie są doskonałym uzupełnieniem mulitdyscyplinarnych projektów prowadzonych w naszym zespole. Rys.1 Schemat nikotynowego. budowy receptora Rys. 2. Struktura dekstrometorfanu. Przesłanką do podjęcia tego typu badań są doniesienia literaturowa wskazujące na kluczową rolę w leczeniu uzależnień częściowego zablokowania receptorów nikotynowych podtypu α3β4. Częściowym antagonistą receptorów nikotynowych jest dekstrometorfan, stosowany od dawna lek na kaszel [Rys.2]. Charakteryzuje się on jednak niską selektywnością wobec receptora α3β4. W oparciu o te informacje oraz wyniki symulacji komputerowych nasz zespół zsyntetyzował serię N - podstawionych pochodnych dekstrometorfanu w celu poprawienia jego selektywności wobec podtypu α3β4. Integralną częścią tych multidyscyplinarnych badań jest ocena aktywności funkcjonalnej opracowanych pochodnych techniką elektrofizjologiczną patch – clamp. Technika patch – clamp uważana jest za najlepszą metodę do badań receptorów jonotropowych. Pozwala na bezpośredni pomiar przepływu jonów wywołany kontrolowanym przez eksperymentatora czynnikiem. Wyniki uzyskane w ten sposób są dokładne, bogate w informacje o oddziaływaniach zachodzących między receptorem a związkiem chemicznym. Całe badanie można przeprowadzić w warunkach jak najbardziej zbliżonych do fizjologicznych. Ponadto istnieje możliwość wyboru konkretnego typu komórek i receptorów nad którymi będą prowadzone badania. Za pomocą szklanej mikroelektrody tworzone jest wysokooporowe (ang. giga seal) połączenie z błoną komórkową aby następnie przy zastosowaniu niewielkiego podciśnienia rozerwać skrawek błony (ang. patch) i uzyskać dostęp do wnętrza komórki (ang. whole – cell) [Rys. 3]. Ruch jonów płynących przez kanały jonowe obecne w błonie komórkowej mierzony jest przy stałej wartości ustalonego potencjału błony (ang. voltage – clamp). Rys. 3 Układ pomiarowy patch – clamp. Prowadzone przeze mnie badania wykonywane są na linii komórkowej HEK 293 stabilnie transfekowanej genami dla receptora α3β4, otrzymanej dzięki uprzejmości zespołu badawczego profesora Wainera z NIA, Baltimore, USA. Komórki użyte do eksperymentów w układzie whole - cell poddane są naprzemiennej stymulacji agonistą, agonistą z badanymi pochodnymi oraz buforem kontrolnym. W pierwszym etapie badań komórka znajdująca się w układzie pomiarowym została poddana działaniu szeregu wzrastających stężeń nikotyny wobec pomiarów kontrolnych. Agonista wywołał otwarcie badanych kanałów i przepływ przez nie jonów. Zmierzone wartości prądu w tych eksperymentach posłużyły do wyznaczenia sigmoidalnej zależności odpowiedzi komórki od logarytmu stężenia nikotyny (ang. dose – response) i określenie wartości EC50 [Rys. 4]. Kolejnym etapem są oddzielne eksperymenty z użyciem szeregu rozcieńczeń badanej pochodnej dekstrometorfanu dozowanych w połączeniu ze stałym stężeniem nikotyny, wyznaczonym w poprzedniej serii eksperymentów. Substancje te będące antagonistami nAChR powodują spadek odpowiedzi komórki w stosunku do kontrolnego roztworu nikotyny. Wyniki pozwolą na wyznaczenie sigmoidalnej zależności dose – response, określenie na jej podstawie wartości IC50 oraz innych parametrów charakteryzujących aktywność antagonistów. Dopełnieniem badań będzie wykonanie analogicznych eksperymentów na innych wybranych podtypach receptorów nikotynowych (α4β2, α7) w celu określenia selektywności oddziaływań. Zbiór otrzymanych istotnie statystycznych danych pozwoli wysnuć wnioski na temat aktywności biologicznej badanych pochodnych dekstrometorfanu wobec neuronalnych receptorów nikotynowych i skierować je na dalsze etapy badań in vivo i in vitro. Rys. 4 Sigmoidalna zależność odpowiedzi komórki od logarytmu stężenia nikotyny.