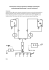Część I
Transkrypt
Część I
Wstęp MATERIAŁY POMOCNICZE DO WYKŁADÓW Z PODSTAW BIOFIZYKI IIIr. Biotechnologii prof. dr hab. inż. Jan Mazerski Wstęp Biofizyka zajmuje się zastosowaniem praw fizycznych i fizykochemicznych do układów ożywionych. Ze względu na rodzaj układu ożywionego można wyróżnić kilka działów biofizyki: - biofizyka środowiska - biofizyka organizmów: medycyna + zoologia + botanika - biofizyka narządów: jw. - biofizyka komórek: mikrobiologia - biofizyka molekularna: biochemia + biotechnologia Na naszych wykładach zajmować się będziemy b i o f i z y k ą m o l e k u l a r n ą , czyli fizycznym i fizykochemicznym opisem biopolimerów. Pod koniec semestru omówimy również wybrane elementy biofizyki komórek: problemy związane z przewodzeniem sygnałów nerwowych oraz z ruchem mechanicznym komórek i narządów. Większość czasu poświęcimy jednak biofizyce molekularnej. Dlaczego do opisu biopolimerów nie wystarcza metodyka wypracowana przez fizykochemię roztworów? Przede wszystkim dlatego, że chemia fizyczna zajmuje się układami wyidealizowanymi: - roztwory doskonałe - roztwory substancji małocząsteczkowych - układy w stanie równowagi termodynamicznej - proste właściwości reologiczne. Jednakże układy ożywione daleko odbiegają od tych wyidealizowanych założeń. Dlatego też biofizyka musi zająć się "niechcianymi" układami: - biopolimery o rozwiniętej i bardzo różnorodnej powierzchni - granica faz biopolimer - wodne roztwory soli i/lub ich mieszanin - strukturami supramolekularnymi (błony lipidowe) - transportem na granicy faz - transport przez błony lipidowe i Część I: Woda w układach biologicznych WODA W UKŁADACH BIOLOGICZNYCH Na początku byłła a woda Wszystkie znane nam układy żywe wykorzystują wodę jako rozpuszczalnik i środowisko procesów biochemicznych. Tak więc zanim przejdziemy do omawiania fizycznych i fizykochemicznych podstaw tych procesów warto poświęcić uwagę temu wszechobecnemu środowisku. Cóż jednak może być ciekawego w wodzie? Każdy, kto uczył się chemii w szkole podstawowej zna jej wzór chemiczny: H2O. Jest to prosta cząsteczka chemiczna zbudowana zaledwie z 3 atomów, której struktura poznana jest obecnie w najdrobniejszych szczegółach. To prawda, a jednak jeżeli zapytamy fizykochemików nie o c z ą s t e c z k ę w o d y , l ecz o s t r u k t u r ę c i e k ł e j w o d y to wywołamy pewną konsternację. Przede wszystkim właściwości fizyczne ciekłej wody nie dają się wyprowadzić ze wzoru cząsteczki wody. Dotyczy to takich właściwości jak: - temperatura wrzenia i molowe ciepło parowania - temperatura i ciepło topnienia - pojemność cieplna - napięcie powierzchniowe - stała dielektryczna - lepkość i wiele innych. 300 250 Temp. wrzenia [C] 200 150 100 50 0 -50 0 50 100 150 200 250 -100 -150 -200 Masa cząsteczkowa Rys.I.1: Zależność temperatury wrzenia n-alkanów od ich masy cząsteczkowej 1 Część I: Woda w układach biologicznych Zajmijmy się dla przykładu temperaturą wrzenia. Wiadomo, że dla prostych związków nieorganicznych i organicznych wielkość ta zależy od masy cząsteczkowej. Np. dla n-alkanów uzyskujemy zależność przedstawioną na Rys.I.1. Widzimy, że temperatura wrzenia rośnie monotonicznie ze wzrostem masy cząsteczkowej. Jeżeli na podstawie tego wykresu chcielibyśmy oszacować masę cząsteczkową wody, to otrzymamy absurdalnie wysoka wartość: ok. 100 daltonów. Popatrzmy teraz, Tab.I-1, na najbliższych krewnych wody, czyli wodorki pierwiastków IV, V, VI i VII grupy głównej. Tabela I-1 Temperatury wrzenia wodorków pierwiastków IV - VII grupy głównej oraz ich masy cząsteczkowe metan -162°C m.cz. 16 si l an -112°C m.cz. 32 germanowodór -89°C m.cz. 77 wodorek cyny -52°C m.cz. 123 amoniak -34°C m.cz. 17 fosforiak -88°C m.cz. 34 arsenowodór -55°C m.cz. 78 antymonowodór -17°C m.cz. 125 woda +100°C m.cz. 18 siarkowodór -61°C m.cz. 34 selenowodór -42°C m.cz. 81 tellurowodór -2°C m.cz. 130 fluorowodór +20°C m.cz. 16 chlorowodór -85°C m.cz. 34 bromowodór -67°C m.cz. 81 jodowodór -40°C m.cz. 128 Monotoniczny wzrost temperatury wrzenia wodorków obserwujemy tylko dla IV grupy głównej, czyli węglowców. W pozostałych grupach sytuacja jest dużo bardziej skomplikowana: woda i jej najbliżsi sąsiedzi wyraźnie odbiegają od ogólnych reguł. Przy tym woda stanowi w pewnym sensie ośrodek tego "zamieszania". Widać to szczególnie wyraźnie na Rys.I.2. Temp. wrzenia [K] 400 300 200 100 0 FLUOROWCE TLENOWCE AZOTOWCE WĘGLOWCE 2 Część I: Woda w układach biologicznych Rys.I.2: Temperatury wrzenia wodorków pierwiastków IV - VII grupy głównej Okazuje się, że sytuacja taka występuje nie tylko w przypadku temperatury wrzenia. Podobnie wygląda sytuacja w przypadku innych właściwości c i e k ł e j w o d y . Struktura ciekłej wody Wyjątkowe właściwości wody wynikają oczywiście z budowy i właściwości jej cząsteczek. Atomy tworzące cząsteczką wody połączone są wiązaniami kowalencyjnymi tworzącymi kąt ok. 104°. Po pierwsze cząsteczki wody posiadają silny moment dipolowy. Μ Wynika on z dużej różnicy elektroujemności pomiędzy atomem tlenu i atomem wodoru. W efekcie atom tlenu staje się ujemnym biegunem dipolu, a środek odległości pomiędzy O δ− δ+ H o 104 Hδ + atomami wodoru biegunem dodatnim. Każdy dipol cząsteczki wody wytwarza wokół siebie pole elektryczne. Oddziaływanie tego pola z polami innych dipoli (cząsteczek wody) lub ładunków (jonów) prowadzi do: - orientacji cząsteczek - oddziaływań elektrostatycznych prowadzących do powstawania agregatów cząsteczek. Po drugie cząsteczka wody zdolna jest do tworzenia silnych wiązań wodorowych. Każda cząsteczka wody może utworzyć 2 wiązania wodorowe w których jej atomy wodoru będą odgrywały rolę donorów oraz 2 wiązania w których wolne pary odgrywać będą rolę akceptorów wiązania. Rys.I.3: Wiązania wodorowe jakie może utworzyć pojedyncza cząsteczka wody W efekcie każda cząsteczka wody stać się może czterowiązalnym węzłem sieci wiązań wodorowych obejmującej w sprzyjających warunkach dziesiątki, setki a nawet tysiące indywidualnych cząsteczek. 3 Część I: Woda w układach biologicznych Istnienie takich agregatów cząsteczkowych powoduje, że w przypadku ciekłej wody powinniśmy właściwie posługiwać się wzorem (H2O)n. Takie podejście pozwala dużo lepiej przewidzieć zachowanie się układów zawierających ciekłą wodę. Cząsteczki wody zdolne są do tworzenia wiązań wodorowych nie tylko pomiędzy sobą, ale również z wieloma polarnymi grupami funkcyjnymi związków organicznych. Z punktu widzenia biofizyki największe znaczenie mają przy tym grupy: hydroksylowa, aminowa, amidowa, karbonylowa i karboksylowa występujące w naturalnych makrocząsteczkach. Pod względem budowy przestrzennej najlepiej poznana jest struktura wody w stanie stałym czyli lodu. W kryształach lodu otrzymanego w normalnych warunkach cząsteczki wody ułożone są w węzłach sieci krystalicznej w odległości 0,267 nm. Fragment takiej sieci przedstawia rysunek: Rys.I.4: Fragment sieci krystalicznej lodu. Kółka symbolizują cząsteczki wody zaangażowane w tetraedrycznym układzie wiązań wodorowych. Na odległość pomiędzy węzłami sieci krystalicznej (atomami tlenu) składa się długość kowalencyjnego wiązania O-H wynosząca 0,099 nm oraz długość wiązania wodorowego wynosząca 0,177 nm. Przedstawiona powyżej struktura lodu nie jest tworem statycznym. Liczne dane doświadczalne jak i wyniki obliczeń komputerowych pokazują, że dzięki energii ruchów termicznych cząsteczki wody w węzłach sieci krystalicznej wykonywać mogą drgania i obroty. Zdarza się że dochodzi wtedy do wymiany partnerów wiązań wodorowych. Powstające nieregularności sieci krystalicznej niwelowane są poprzez ruchy relaksacyjne sąsiednich 4 Część I: Woda w układach biologicznych cząsteczek. Jak wykazały badania z zastosowaniem znaczników izotopowych nieregularności takie odpowiedzialne są za zjawiska takie jak dyfuzja małych cząsteczek w krysztale lodu oraz wymiana cząsteczek pomiędzy kryształem i otaczającą go ciekłą wodą. Struktura wody w stanie ciekłym nie jest możliwa do jednoznacznego, statycznego opisania. W wodzie jako cieczy istnieje niewątpliwie znaczny stopień nieuporządkowania. Z drugiej jednak strony istnieje wiele pośrednich danych doświadczalnych wskazujących, że w ciekłej wodzie występują również pewne ugrupowania, asocjaty cząsteczek (klastery). Ich wielkość zależy od temperatury i szacuje się, że w temperaturze pokojowej zawierać one mogą średnio ok. 100 cząsteczek wody. Istnieją silne przesłanki, że te klastery stanowić mogą pozostałości, fragmenty sieci krystalicznej lodu. Z rozważań energetycznych wynika, że przy topnieniu lodu zerwaniu ulega tylko ok. 15% wiązań wodorowych. Oznacza to, że w ciekłej wodzie w temperaturze ok. 0°C zachowana jest znaczna część struktury krystalicznej lodu. W miarę wzrostu temperatury wielkość tych fragmentów szybko maleje, ale nawet w pobliżu temperatury wrzenia występować jeszcze mogą kilkucząsteczkowe klastery będące pozostałościami sieci krystalicznej lodu. Proste rozważania geometryczne pokazują, że ze względu na geometrię cząsteczki wody najprostszym możliwym klastrem pozbawionym napięć powinien być pięciokąt foremny z cząsteczkami wody w narożach. A) B) Rys.I.5: Schemat dwóch możliwych struktur klatratów utworzonych z cząsteczek wody. Kółka na rysunku symbolizują pozycje atomów tlenu. A) wypukły klatrat utworzony z 20 cząsteczek wody; wszystkie ściany są pięciokątami foremnymi, B) klaster gwiaździsty otworzony z 15 cząsteczek wody; można się w nim doszukać pozostałości sieci krystalicznej lodu. Oprócz pozostałości sieci krystalicznej lodu w ciekłej wodzie występują również klastery o odmiennej strukturze. Mogą to być np. tzw. klatraty których strukturę przedstawiono na Rys.I.5 A. 5 Część I: Woda w układach biologicznych Mają one formę regularnego dwunastościanu o ścianach w kształcie foremnych pięciokątów. Ponieważ każdy atom tlenu występujący w narożu klatratu ma jeszcze potencjalnie jeden niewysycony kierunek oddziaływania, więc klatraty tworzyć mogą trójwymiarową sieć wypełniającą całą przestrzeń. Odległości pomiędzy narożami klatratu (węzłami sieci) są większe niż w strukturze lodu. Jest to skutkiem wzrostu długości wiązań wodorowych i wskazuje na ich osłabienie. W tej sytuacji wnętrze klatratu tworzy na tyle obszerną klatkę, że może się w niej zmieścić dodatkowa cząsteczka wody lub inna mała cząsteczka. W ciekłej wodzie tworzyć się mogą również struktury pośrednie pomiędzy strukturą lodu i klatratem (Rys.I.5 B). Tak więc w ciekłej wodzie współistnieje obok siebie wiele różnych elementarnych jednostek strukturalnych. W skład kilkudziesięciocząsteczkowych klasterów wchodzą prawdopodobnie przedstawiciele opisanych wyżej oraz wielu innych elementarnych jednostek strukturalnych. Klasterów takich nie można traktować jako konfiguracji trwałych. Ruchy termiczne powodują, że zarówno klastery jak i mniejsze jednostki strukturalne tworzą się i rozpadają dynamicznie. Średnia energia kinetyczna (translacyjna i rotacyjna) pojedynczej cząsteczki wody w temperaturze 300 K wynosi ok. 7 kJ/mol, a energia oddziaływania dwóch cząsteczek wody jest nie większa niż ok. 20 kJ/mol. Obliczono, że średni czas życia klasterów wynosi w tych warunkach ok. 10 ps (10-11 s). Sytuacja staje się jeszcze bardziej skomplikowana, gdy analizujemy struktury roztworów wodnych. W zależności od budowy chemicznej substancji rozpuszczonej możemy mieć do czynienia z bardzo złożonymi zjawiskami. Spróbujmy przeanalizować niektóre z nich. Roztwory soli W trakcie rozpuszczania kryształów soli dochodzi do dysocjacji na jony. Każdy z jonów wytwarza wokół siebie pole elektryczne, które oddziałuje z cząsteczkami wody posiadającymi charakter dipolowy. Pole elektryczne dąży do zorientowania dipoli wody równolegle do linii sił pola. W przypadku jonów o symetrii kulistej, np. kationów metali, linie sił pola mają również symetrię kulistą. Cząsteczki wody tworzą wtedy sferyczną warstwę wokół jonu. Orientacja cząsteczek wody w takiej warstwie zależy od znaku ładunku jonu (Rys.I.6). W przypadku kationów atomy tlenu stanowiące ujemne bieguny dipoli znajdują się bliżej jonu niż atomy wodoru. Powstaje warstwa hydratacyjna składająca się ze zorientowanych cząsteczek wody. W jej warstwie zewnętrznej przeważają (w przypadku kationów) atomy wodoru będące dodatnimi biegunami dipoli. Jednakże pole elektryczne jonu sięga dalej niż grubość pojedynczej warstwy hydratacyjnej. Ponadto nagromadzenie na powierzchni zewnętrznej atomów wodoru zdolnych do tworzenia wiązań wodorowych sprzyja orientacji cząsteczek wody stykających się z taką warstwą. Tworzy się 6 Część I: Woda w układach biologicznych więc kolejna warstwa hydratacyjna o orientacji analogicznej jak pierwsza. Również na jej powierzchni mamy do czynienia z nagromadzeniem atomów wodoru. Istnieje więc możliwość powstania kolejnej warstwy hydratacyjnej. O tym ile warstw hydratacyjnych powstaje wokół jonu decyduje promień jonu i wielkość jego ładunku. Im jon jest mniejszy i posiada większy ładunek tym silniejsze jest jego pole elektryczne i tym większa liczba warstw hydratacyjnych. W pewnej odległości od jonu jego pole staje się już na tyle słabe, że nie jest w stanie przeciwstawić się ruchom termicznym. Pojawia się strefa o nieuporządkowanej strukturze, a w jeszcze większych odległościach przeważa struktura typowa dla ciekłej wody. RDF RDF 3.50 3.50 3.00 K + 2.50 2.50 2.00 2.00 1.50 1.50 1.00 1.00 0.50 0.50 0.00 0.00 0.00 0.20 0.40 0.60 r[nm] Cl 3.00 0.80 0.00 0.20 0.40 0.60 0.80 r[nm] Rys.I.6: Przykłady radialnych funkcji rozkładu atomów wody wokół jonów: kationu potasowego (po lewej) i anionu chlorkowego (po prawej) uzyskane dzięki modelowaniu komputerowemu. Linią czarną zaznaczono rozkład gęstości atomów wodoru, a linią szarą atomów tlenu cząsteczki wody Przedstawiony tu statyczny obraz hydratacji jonów jest bardzo wyidealizowanym modelem. W rzeczywistości cząsteczki wody nie tworzą wokół jonów trwałych warstw hydratacyjnych. Chcąc dokonać bardziej wiarygodnej analizy sytuacji występującej w roztworach soli musimy zastosować opis statystyczny uśredniający zmienny w czasie rozkład i orientację cząsteczek wody. Niektóre techniki modelowania komputerowego, np. dynamika molekularna, pozwalają uzyskać szereg geometrii modelowanego układu w sekwencji czasowej. Dane takie mogą stanowić podstawę do wyznaczenia średniego rozkładu cząsteczek wody wokół wybranych atomów lub grup atomów. Najczęściej w tym celu wykorzystywana jest tzw. r a d i a l n a f u n k c j a d y s t r y b u c j i (RDF), czyli liczba danego typu atomów rozpuszczalnika w jednostce objętości w odległości r od 7 Część I: Woda w układach biologicznych wybranego atomu substancji rozpuszczonej. Dla ułatwienia porównania rozkładów różnych typów atomów, np. tlenu i wodoru w przypadku wody, uzyskane wartości RDF dzieli się przez średnią gęstość danego typu atomu w roztworze. Przykłady takich radialnych funkcji dystrybucji dla atomów tlenu i wodoru z cząsteczek wody wokół kationu potasowego i anionu chlorkowego przedstawia Rys.I.6. Na przedstawionych wykresach RDF widać wyraźnie, że wokół obu jonów tworzą się zorientowane, wielowarstwowe powłoki hydratacyjne. Najsilniej zorientowana jest pierwsza powłoka hydratacyjna. W miarę wzrostu odległości stopień orientacji staje się coraz mniejszy i wreszcie zanika. Występowanie powłok hydratacyjnych wokół jonów tłumaczy istnienie zjawiska dysocjacji soli w roztworach wodnych. Przyciąganie elektrostatyczne pomiędzy jonami przeciwnych znaków otoczonymi powłokami hydratacyjnymi jest na tyle słabe, że przynajmniej w rozcieńczonych roztworach, nie powinno występować tworzenie się par jonowych. Jednakże ze wzrostem stężenia średnie odległości pomiędzy jonami przeciwnych znaków zmniejszają się na tyle, że dochodzi do pojawiania się par jonowych. Model taki tłumaczy, co najmniej jakościowo, zależność stopnia dysocjacji od stężenia roztworu. Istnienie powłok hydratacyjnych wokół jonów można wykryć również pośrednio metodami doświadczalnymi. Wykorzystuje się w tym celu pomiary przewodnictwa równowagowego jonów. Znając wartość przewodnictwa równowagowego danego rodzaju jonu i przyjmując, że wraz z otoczką hydratacyjną jony mają kształt kulisty można, korzystając z praw hydrodynamiki, np. równania Stokesa, oszacować promień poruszającego się nośnika ładunku. Wyniki uzyskane tą metodą dla kationów litowców przedstawia Tab.I-2. Tabela I-2. Wartości efektywnych promieni hydratacyjnych w nieskończenie rozcieńczonych roztworach wodnych i promieni jonowych dla kationów litowców Promień Promień jonowy hydratacyjny [nm] [nm] 0,240 0,060 0,185 0,095 K+ Rb+ 0,126 0,133 0,119 0,148 Cs+ 0,120 0,169 Jon Li+ Na+ 8 Część I: Woda w układach biologicznych Jest przy tym charakterystyczne, że tak obliczony "efektywny" promień hydratowanego jonu maleje ze wzrostem liczby atomowej. Zależność ta jest odwrotna do zależności obserwowanej w przypadku promieni jonów nieuwodnionych, np. w kryształach. Dla porównania Tab.I-2. zawiera również wartości promieni jonowych wyznaczonych dla kryształów soli. Występowanie odwrotnej proporcjonalności pomiędzy promieniem hydratowanego jonu i promieniem jonu w krysztale wynika właśnie z obecności powłoki hydratacyjnej. Jony o małym promieniu jonowym, np. Li+, potrafią silnie związać grubą powłokę hydratacyjną, a jony o dużym promieniu jonowym, np. Cs+, nie potrafią w czasie ruchu w środowisku wodnym utrzymać swoich słabo związanych powłok hydratacyjnych i zachowują się jak jony nieuwodnione. Należy przy tym zwrócić uwagę, że podane wartości promieni jonów hydratowanych nie należy traktować zbyt dosłownie jako promieni stref hydratacyjnych. Po pierwsze wielkości te zostały wyznaczone z pomiarów dynamicznych (jony w ruchu) i mamy podstawy przypuszczać, że dla jonów nie wykonujących ruchu pod wpływem pola elektrycznego zasięg uporządkowania cząsteczek wody będzie większy. Po drugie, równanie Stokesa użyte do ich obliczenia traktuje wodę jako środowisko ciągłe, pozbawione struktury cząsteczkowej. Jednakże uzyskane wartości promieni są rzędu rozmiarów cząsteczek wody. Są to więc wartości "efektywne", przybliżone, a nie rzeczywiste promienie zasięgu oddziaływania jonów z otaczającymi je cząsteczkami wody. Pomimo tych zastrzeżeń promienie hydratacyjne jonów pozwalają wyjaśnić niektóre zjawiska obserwowane przy transporcie jonów przez błony biologiczne i sztuczne błony lipidowe. W doświadczeniach takich obserwuje się np. często, że jony potasu transportowane są łatwiej niż jony sodu. Jest to sprzeczne z promieniami jonowymi tych jonów, ale całkowicie zgodne z ich promieniami hydratacyjnymi. Roztwory makrocząsteczek Jak widzieliśmy powyżej, już zbudowanie poprawnego, fizykochemicznego modelu roztworu soli napotyka na poważne problemy. Sytuacja staje się jeszcze trudniejsza w przypadku roztworów zawierających polarne makrocząsteczki. Analizę takich roztworów prowadzi się zwykle na dwóch etapach: - makrocząsteczki w wodzie - makrocząsteczki w roztworach soli. W pierwszym etapie rozważa się przede wszystkim hydratację makrocząsteczek i rolę cząsteczek wody w stabilizacji struktury II- i III-rzędowej. W etapie drugim analizuje się wpływ 9 Część I: Woda w układach biologicznych makrocząsteczki na zmiany stężeń jonów w jej otoczeniu i wynikające z tego zmiany właściwości fizykochemicznych szczególnie w obecności zewnętrznego pola elektrycznego. Hydratacja makrocząsteczek. Praktycznie wszystkie makrocząsteczki o znaczeniu biologicznym (białka, polisacharydy i kwasy nukleinowe) posiadają na swojej powierzchni wiele grup zjonizowanych lub, co najmniej ugrupowań silnie polarnych, np. grupy hydroksylowe w polisacharydach. Jest to niezbędne dla zapewnienia tym makrocząsteczkom rozpuszczalności w wodzie. Sytuacja nie jest jednak wcale taka oczywista. Istnieje np. szereg białek strukturalnych o bardzo małej rozpuszczalności w wodzie pomimo obecności na ich powierzchni licznych grup polarnych, np. niektóre odmiany kolagenu lub keratyna włosów. Przykłady słabej rozpuszczalności związków organicznych pomimo obecności silnie polarnych, hydrofilowych grup funkcyjnych znaleźć można nawet wśród związków małocząsteczkowych. Szczególnie spektakularne przykłady spotyka się w grupie cukrów prostych i disacharydów, gdyż z obserwacji codziennych wiemy, że cukier (sacharoza) rozpuszcza się w wodzie bardzo dobrze (ok. 200 g w 100 g wody w temp. pokojowej i ponad 400 g w temp. 100°C). Jednakże inne disacharydy mają bardzo różną rozpuszczalność, np. maltoza tylko ok. 100 g, a laktoza nawet tylko 17 g w 100 g wody. Również wśród cukrów prostych obserwujemy duże różnice rozpuszczalności w wodzie. I tak fruktoza ma rozpuszczalność 355 g/100 g wody, glukoza 150, sorboza 83 a galaktoza tylko 20 g/100 g wody w temp. pokojowej. Powyższe przykłady wskazują wyraźnie, że rozpuszczalność zależy nie tylko od ilości, ale również rozmieszczenia grup polarnych. Rozmieszczenie to ma bowiem istotny wpływ na trwałość otoczki hydratacyjnej wokół cząsteczki. Wypada w tym miejscu zaznaczyć, że w przeciwieństwie do powłok hydratacyjnych jonów, otoczki hydratacyjne biopolimerów mogą mieć i często mają bardzo skomplikowaną budowę. Duży stopień komplikacji takiej otoczki wynika z bardzo skomplikowanej geometrii pola elektrostatycznego występującego na powierzchni makrocząsteczek: i) obecność różnorodnych grup funkcyjnych ii) bliskie sąsiedztwo ładunków (ładunków cząstkowych) o przeciwnych znakach iii) rozwinięta powierzchnia makrocząsteczek. W pobliżu różnych części tej samej makrocząsteczki możemy spodziewać się występowania otoczki hydratacyjnej o bardzo różnym stopniu i kierunku uporządkowania. W pobliżu grup zjonizowanych będą to fragmenty silnie uporządkowane. W pobliżu grup silnie polarnych, zdolnych do tworzenia wiązań wodorowych, lecz nie posiadających formalnie charakteru jonów 10 Część I: Woda w układach biologicznych (np. grupa hydroksylowa lub amidowa) spodziewać się możemy otoczki silnie powiązanej z biopolimerem, lecz o słabszej orientacji. Wreszcie w sąsiedztwie fragmentów niepolarnych (łańcuchy alifatyczne, pierścienie aromatyczne) otoczka może wcale nie występować lub być bardzo słabo zaznaczona. RDF RDF 3.50 3.50 3.00 3.00 2.50 -COO - 2.00 2.00 1.50 1.50 1.00 1.00 0.50 0.50 0.00 0.00 0.00 0.20 0.40 0.60 + -NH 3 2.50 0.00 0.80 0.20 r[nm] RDF 0.60 0.80 0.60 0.80 RDF 3.50 3.50 3.00 3.00 2.50 2.00 2.00 1.50 1.50 1.00 1.00 0.50 0.50 0.00 0.00 0.20 0.40 -CH 3 2.50 -OH 0.00 0.40 r[nm] 0.60 0.80 r[nm] atomy wodoru 0.00 0.20 0.40 r[nm] atomy tlenu Rys.I.7: Radialne funkcje dystrybucji wokół wybranych grup funkcyjnych w makrocząsteczkach Modelowanie molekularne układów zawierających biopolimery lub ich fragmenty w otoczeniu cząsteczek wody pokazało, że przy odpowiednim rozmieszczeniu grup funkcyjnych, możliwe jest tworzenie się na powierzchni makrocząsteczki klasterów cząsteczek wody o charakterystycznej geometrii. Co ciekawe, struktury takie (np. pierścienie 5-członowe zbudowane z 5 cząsteczek wody) odkryto w kryształach niektórych polipeptydów, białek i kwasów nukleinowych. Cząsteczki wody wchodzące w skład otoczki hydratacyjnej mogą przy tym spełniać istotną rolę w stabilizacji struktury biopolimeru (Rys.I.8). Ma to miejsce szczególnie w przypadku silnie rozbudowanej powierzchni cząsteczki tworzącej "nisze". Jeśli w takiej niszy występują naładowane grupy funkcyjne zdolne do uczestniczenia w 11 Część I: Woda w układach biologicznych wiązaniach wodorowych to dojść może to powstania tzw. m o s t k a w o d n e g o , czyli ciągu cząsteczek wody połączonych ze sobą wiązaniami wodorowymi. Wydaje się, że szczególnie trwałe są mostki wodorowe zawierające 1 lub 2 cząsteczki wody. N H + H H O H O H H O Rys.I.8: Rola mostków wodnych w stabilizacji struktury biopolimeru Otoczka hydratacyjna odgrywa również istotną rolę w oddziaływaniach pomiędzy makrocząsteczkami. Gdy dwie makrocząsteczki łączą się tworząc strukturę IV-rzędu, woda tworząca początkowo otoczkę hydratacyjną w miejscu styku makrocząsteczek musi zostać usunięta lub, co najmniej jej organizacja musi ulec istotnym zmianom. Tym samym woda ta odgrywa rolę składnika chemicznego (substratu?) w reakcji asocjacji wpływając na tworzenie się struktur ponadcząsteczkowych (supramolekularnych). Otoczka hydratacyjna decydować może zarówno o szybkości procesu asocjacji jak i o strukturze powstającego asocjatu. Wydaje się, że obszary powierzchni cząsteczki posiadające jedynie cienką, słabo zorientowaną otoczkę hydratacyjną są naturalnymi kandydatami na takie powierzchnie styku. I tak się w rzeczywistości dzieje. Otoczka o podanej powyżej charakterystyce jest typowa dla niepolarnych fragmentów biopolimeru. Fragmenty takie mają dużą skłonność do unikania kontaktu z cząsteczkami wody, mówimy, że są hydrofobowe. Jednym ze sposobów zabezpieczenia się przed kontaktem z wodą jest kontakt z innym, również hydrofobowym fragmentem powierzchni. Efektem występowania oddziaływań hydrofobowych w obrębie pojedynczej cząsteczki biopolimeru jest nagromadzenie się takich fragmentów z dala od powierzchni cząsteczki - w jej wnętrzu. W przypadku międzycząsteczkowego oddziaływania hydrofobowego mamy do czynienia z asocjacją makromolekuł, np. z powstawaniem w pełni funkcjonalnego enzymu z cząsteczek białek tworzących jego podjednostki. Nie zawsze jednak fragmenty hydrofobowe występują wewnątrz makromolekuły. Znane są liczne białka, należące do klasy białek błonowych, w których większość fragmentów hydrofobowych znajduje się na cylindrycznej powierzchni bocznej tych białek. Te hydrofobowe powierzchnie 12 Część I: Woda w układach biologicznych przeznaczone są do kontaktu z również hydrofobowymi łańcuchami kwasów tłuszczowych w wewnętrznych obszarach biwarstwy lipidowej. Makrocząsteczki w roztworach soli W warunkach fizjologicznych powierzchnie biopolimerów są w kontakcie nie z czystą wodą, lecz z roztworami wodnymi zawierającymi znaczące ilości rozpuszczonych soli. Siła jonowa płynów ustrojowych w organizmie człowieka odpowiada 150 mM roztworowi NaCl. Jony obecne w roztworze mają przy tym tendencję do grupowania się wokół naładowanych grup związanych z powierzchnią biopolimeru. Otoczka jonów tworzy tzw. warstwę podwójną. Jej skład zależy od znaku ładunku grup naładowanych biopolimeru. Wokół dodatnio naładowanych grup występuje warstwa anionów, a w przypadku grup o ładunku ujemnym warstwa kationów. Taka warstwa podwójna wywiera silne działanie ekranujące obniżając siłę oddziaływań elektrostatycznych pomiędzy ładunkami związanymi z powierzchnią jednej makrocząsteczki jak i pomiędzy różnymi makrocząsteczkami. Jako pierwszy istnienie takich warstw przewidział Helmholtz. On też jako pierwszy zajmował się ich budową. W modelu Helmholtza warstwa podwójna składa się z ładunków powierzchniowych biopolimeru i uporządkowanej warstwy jonów pochodzących z roztworu. Odległość tych przeciwjonów od powierzchni biopolimeru jest w modelu Helmholtza stała. Takiej warstwie podwójnej, tzw. w a r s t w i e H e l m h o l t z a , odpowiada liniowa zmiana potencjału z odległością (Rys.I.9 A). Okazało się, że w niektórych przypadkach model Helmholtza odbiega od obserwowanych zależności. Gouy i Chapman zaproponowali więc inny model warstwy podwójnej, tzw. p o d w ó j n ą w a r s t w ę d y f u z y j n ą . Myślą przewodnią tego modelu jest założenie, że przeciwjony dążą w zasadzie do utworzenia podwójnej warstwy Helmholtza, lecz przeszkadzają im ruchy termiczne. W efekcie struktura warstwy dyfuzyjnej jest wypadkową obu tych procesów i przypomina model atmosfery Ziemi: w pobliżu powierzchni biopolimeru gęstość przeciwjonów jest największa i wraz z odległością maleje w przybliżeniu wykładniczo. W efekcie potencjał nie jest liniową funkcją r i sięga głębiej w roztwór niż przy podwójnej warstwie Helmholtza, Rys.I.9 B. Podstawą matematyczną modelu jest statystyczny rozkład przeciwjonów zgodnie z rozkładem Boltzmanna. Model dyfuzyjnej warstwy podwójnej jest zgodny z doświadczeniem dla roztworów o niewielkim stężeniu. 13 Część I: Woda w układach biologicznych A) B) C) ψ ψ r ψ r r Rys.I.9: Schemat różnych modeli warstw podwójnych na powierzchni biopolimeru. Powierzchnia biopolimeru posiada ładunki dodatnie. Kółeczka oznaczają aniony tworzące warstwę przeciwjonów. A) - warstwa Helmholtza; B) - dyfuzyjna warstwa podwójna; C - warstwa podwójna Sterna. Wykresy poniżej schematów przedstawiają zmiany potencjału ψ jako funkcję odległości r. Przy większych stężeniach pojawiają się jednak znaczne rozbieżności pomiędzy przewidywaniami modelu i danymi doświadczalnymi. Dlatego poszukiwano jeszcze lepszego modelu. Ciekawy model zaproponował Stern. Połączył on modele Helmholtza i Chapmana przyjmując, że część przeciwjonów tworzy rzeczywiście warstwę podwójną zgodną z modelem Helmholtza. Jednakże zgodnie z założeniem Sterna, ładunek tych jonów nie jest wystarczający dla zrównoważenia ładunku powierzchniowego biopolimeru. Pozostałe przeciwjony tworzą dyfuzyjną warstwę podwójną. Podział ładunku (liczby przeciwjonów) pomiędzy obie podstruktury zależy od stężenia roztworu. Przy niskich stężeniach wszystkie lub prawie wszystkie przeciwjony znajdują się w warstwie dyfuzyjnej. Wraz ze wzrostem stężenia jonów coraz silniej obsadzana jest jednak warstwa Helmholtza. Zgodnie z modelem Sterna zależność potencjału od r ma początkowo charakter liniowy, a po przekroczeniu odległości Helmholtza przekształca się w zależność wykładniczą (Rys.I.9 C). W efekcie spadek potencjału jest dużo wolniejszy niż w modelu warstwy dyfuzyjnej. Model Sterna uwzględnia ponadto inne, nie tylko elektrostatyczne, oddziaływania 14 Część I: Woda w układach biologicznych pomiędzy powierzchnią biopolimeru i przeciwjonami. Umożliwia to tworzenie poprawnych modeli warstwy podwójnej nie tylko dla roztworów prostych soli, np. NaCl, ale również dla roztworów zawierających zjonizowane związki organiczne. W takich roztworach na skutek oddziaływań absorpcyjnych w warstwie podwójnej może występować nadwyżka przeciwjonów która w skrajnych przypadkach może spowodować nawet odwrócenie potencjału pola. 15