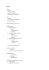TRm Vp ⋅⋅=⋅ xx
Transkrypt
TRm Vp ⋅⋅=⋅ xx
TERMODYNAMIKA GAZY DOSKONAŁE I PÓŁDOSKONAŁE Prawo Boyle’a i Mariotte’a Prawo Gay-Lussaca p ⋅ V = const, gdy T = const, V T = const, gdy p = const, Równanie stanu gazu doskonałego i półdoskonałego p ⋅ v = Ri ⋅ T, gdzie: p – ciśnienie bezwzględne, Pa, v – objętość właściwa, m3/kg, 1 V = , gdzie ρ - gęstość, kg/m3 v= ρ m Ri – indywidualna stała gazowa, J , kg ⋅ K T – temperatura, K. V – objętość, m3, m – masa, kg. p ⋅ V = m ⋅ Ri ⋅ T, gdzie: p ⋅ V = n ⋅ (MR) ⋅ T, gdzie: n – ilość moli, kmol, (MR) – uniwersalna stała gazowa, J kmol ⋅ K p ⋅ V& = m& ⋅ Ri ⋅ T , gdzie: V& -strumień objętości, m3/s m& - strumień masy, kg/s m = n ⋅ M, gdzie M – masa cząsteczkowa związku, kg/kmol Strumienie masy i objętości Strumień objętości: V& = S ⋅ w , gdzie: S – pole przekroju, m2, w – średnia prędkość, m/s. Strumień masy: m& = V& ⋅ ρ = S ⋅ w ⋅ ρ Uniwersalna stała gazowa: (MR)= 8315 J kmol ⋅ K (MR ) , J Indywidualna stała gazowa związku: Ri = kg ⋅ K Mi Warunki normalne: pn = 101325 Pa, tn = 0oC 1 Roztwory Udział kilomolowy (molowy): z i = ni , przy czym n k ∑n i =1 k = n oraz ∑ z i = 1 , gdzie: i i =1 ni - ilość moli danego składnika r-ru n - ilość moli całego r-ru Udział kilogramowy (masowy): g i = mi , przy czym m mi - masa danego składnika r-ru m - masa całego r-ru V Udział objętościowy: ri = i , przy czym V p ,T k k i =1 i =1 ∑ mi = m oraz ∑ g i = 1 , gdzie: k k i =1 i =1 ∑ Vi = V oraz ∑ ri = 1 , gdzie: Vi - objętość danego składnika r-ru V - objętość całego r-ru ri = z i ZaleŜność między udziałami masowymi a molowymi i objętościowymi: M M g i = i ⋅ z i = i ⋅ ri , gdzie: Mz – zastępcza masa cząsteczkowa roztworu: Mz Mz k M z = ∑ (z i ⋅ M i ) = i =1 1 , kg , gdzie: kmol gi ∑ i =1 M i k M i - masa molowa danego składnika r-ru k Zastępcza stała gazowa roztworu: R z = ∑ ( g i ⋅ Ri ), i =1 J kg ⋅ K , gdzie: Ri - stała gazowa danego składnika r-ru Rz = (MR ) , Mz J kg ⋅ K ; R z ⋅ M z = 8315 J kmol ⋅ K k Gęstość roztworu gazów: ρ = ∑ (ri ⋅ ρ i ), kg i =1 m3 , gdzie: ρ i - gęstość danego składnika r-ru Prawo Daltona: pi = p ⋅ ri = p ⋅ z i , gdzie: pi - ciśnienie cząstkowe składnika r-ru p - ciśnienie bezwzględne całego r-ru k ∑p i =1 i =p 2 PRACA ABSOLUTNA, UśYTECZNA, TECHNICZNA Praca absolutna (bezwzględna, objętościowa); gdy 0 1 , 2 Praca uŜyteczna; gdy 0 , gdzie: - ciśnienie otoczenia, - praca kompresji otoczenia. Praca techniczna , - dla przemian nieliniowych , - dla przemian liniowych , , gdzie N- moc silnika, W CIEPŁO WŁAŚCIWE, CIEPŁO PRZEMIANY Ciała o stałym cieple właściwym Kilogramowe ciepło właściwe (kilogramowa właściwa pojemność cieplna) . c – ilość ciepła potrzebna do ogrzania 1 kg ciała o 1 stopień; Do ogrzania m kilogramów ciała o ∆t (∆T) potrzeba ciepła: · # · $% · &" &! lub !" # · $% · '" '! , a takŜe !" # · $( · &" &! lub !" # · $( · '" '! , gdzie: cp – kilogramowe ciepło właściwe pod stałym ciśnieniem, · !" J J cv – kilogramowe ciepło właściwe w stałej objętości, · ti – temperatura, °C Ti – temperatura, K. cp – cv = R; cp=(Mcp):M Kilomolowe ciepło właściwe (kilomolowa właściwa pojemność cieplna) (Mc) – ilość ciepła potrzebna do ogrzania 1 kmol ciała o 1 stopień; )*+·. Do ogrzania n kilomoli ciała o ∆t (∆T) potrzeba ciepła: , · -$% · &" &! lub !" , · -$% · '" '! , J a takŜe !" , · -$( · &" &! lub !" , · -$( · '" '! , J gdzie: Mcp – kilomolowe ciepło właściwe pod stałym ciśnieniem, )*+· !" Mcv – kilomolowe ciepło właściwe w stałej objętości, )*+· ti – temperatura, °C Ti – temperatura, K. 3 (Mcp) – (Mcv)= MR=8315 . /012·3 Ciała o zmiennym cieple właściwym Średnie kilogramowe ciepło właściwe gazów półdoskonałych w zakresie temperatur od T1 do T2 (K): w zakresie temperatur od t1 do t2 (°C): 4 &" 4 &! 4$|&" $|6 ·&"$|6 ·&!, &! &" &! 4 '" ·'" 4$|'! ·'! 6 4$|'" $|6 '! · '" '! , · (w ten sam sposób moŜna obliczyć zarówno średnie kilogramowe ciepło właściwe w stałej objętości cv jak i średnie kilogramowe ciepło właściwe przy stałym ciśnieniu cp). Średnie kilomolowe ciepło właściwe gazów półdoskonałych w zakresie temperatur od t1 do t2 (°C): w zakresie temperatur od T1 do T2 (K): 4 &" 4 &! 4-$|&" -$|6 ·&"-$|6 ·&!, &! &" &! 4 '" 4-$|'" -$|6 '! · ' ·'" -4$|6! ·'! '" '! (w ten sam sposób moŜna obliczyć zarówno średnie kilomolowe ciepło właściwe w stałej objętości (Mcv) jak i średnie kilomolowe ciepło właściwe przy stałym ciśnieniu (Mcp)). · Do ogrzania m kilogramów ciała o ∆t (∆T) potrzeba ciepła: a takŜe !" !" & # · 4$|&"! · &" &! lub & & # · 4$| " · &" 4$| ! · &! lub !" 6 6 & , · 4-$|&"! · &" &! lub & & , · 74-$| " · &" 4-$| ! · &! 8 lub !" 6 6 !" !" !" !" ' # · 4$|'"! · '" '! , J ' ' # · 4$| " · '" 4$| ! · '! , 6 6 J ' , · 4-$|'"! · '" '! , J ' ' , · 74-$| " · '" 4-$| ! · '! 8, 6 4-$% 9& – 4-$( |& = 8315 lub 4-$% 9' – 4-$( |' = 8315 6 6 )*+⋅ )*+⋅ 6 6 J 6 Ciepło właściwe roztworu gazów Kilogramowe ciepło właściwe roztworu gazów: # $ : ;< · $< , <=! J kg · K gdzie: BC – udziały masowe składników roztworu. DC – kilogramowe ciepło właściwe składnika roztworu Kilomolowe ciepło właściwe roztworu gazów: # -$ : E< · -$< , <=! J kmol · K gdzie: IC – udziały molowe składników roztworu. JDC – kilomolowe ciepło właściwe składnika roztworu 4 PIERWSZA ZASADA TERMODYNAMIKI Energia wewnętrzna U = m ⋅ u, J, gdzie: m – masa, kg, u – energia wewnętrzna właściwa, J/kg Analogicznie: U = n ⋅ (Mu) Dla gazów doskonałych moŜna zapisać zaleŜności: u = cv ⋅ T, (Mu) = (Mcv) ⋅ T Stąd: U = m ⋅ cv ⋅ T = n⋅ (Mcv) ⋅ T Dla gazów półdoskonałych – analogicznie: u = 4$( |&6 ⋅ t lub u = 4$( |'6 ⋅ T (Mu) =4-$( |&6 ⋅ t lub (Mu) =4-$( |'6 ⋅ T U = m ⋅ 4$( |&6 ⋅ t = n⋅ 4-$( |&6 ⋅ t lub U = m ⋅ 4$( |'6 ⋅ T = n⋅ 4-$( |'6 ⋅ T Pierwsza zasada termodynamiki DLA SYSTEMÓW ZAMKNIĘTYCH – pierwsza postać równania pierwszej zasady termodynamiki: Q = ∆U + L1-2, J gdzie ∆U- przyrost energii wewnętrznej, ∆U=U2-U1 Entalpia – suma energii wewnętrznej i energii przetłaczania (pracy przetłaczania) I = U + p ⋅ V, J Entalpia właściwa (entalpia 1 kg czynnika): i = u + p ⋅ v, J/kg Entalpia gazów doskonałych i = cp ⋅ T, poniewaŜ cv + R = cp, i = (cv + R) ⋅ T (Mi) = (Mcp) ⋅ T. I = m ⋅ cp ⋅ T = n ⋅ (Mcp) ⋅ T, J 5 Entalpia gazów półdoskonałych i = 4$% 9 ⋅ t lub i = 4$% 9 ⋅ T 6 6 i = 4$( |&6 K⋅ t, lub i = 4$( |'6 K⋅ T, & ' (Mi) = 4-$% 9 ⋅ t lub (Mi) = 4-$% 9 ⋅ T & ' 6 6 & & ' ' I = m ⋅ 4$% 9 ⋅ t = n ⋅ 4-$% 9 ⋅ t lub I = m ⋅ 4$% 9 ⋅ T = n ⋅ 4-$% 9 ⋅ T, J 6 6 6 6 Energia dopływająca do układu lub odpływająca z układu wraz ze strumieniem czynnika (np. rurociągiem) jest sumą entalpii, energii potencjalnej, kinetycznej i chemicznej czynnika. Jeśli prędkość czynnika w<40 m/s oraz wysokość h<100 m i nie zachodzi reakcja chemiczna, to moŜna zapisać: Ed = I = m i = n ⋅ (Mi) Pierwsza zasada termodynamiki dla SYSTEMÓW OTWARTYCH – druga postać równania pierwszej zasady termodynamiki – bilans maszyny przepływowej: Q = ∆I + Lt 1-2 gdzie ∆I- przyrost entalpii, ∆I=I2-I1 PRZEMIANY ODWRACALNE GAZÓW DOSKONAŁYCH DL DP M JDL N NM N Q RS RT ORS JDP OM N NOM N ORT Przemiana izobaryczna, p = const. Z prawa Gay-Lussaca: Praca bezwzględna: Praca techniczna: U U ⋅ , J 0 Ciepło przemiany izobarycznej (dla gazów doskonałych - o stałej pojemności cieplnej) wynosi: V W · DP · U U X · JDP · U U , J V ∆Z , J 6 Przemiana izochoryczna, V = const. U U Prawo Charlesa: Praca bezwzględna: 0 Praca techniczna: · , J Ciepło przemiany izochorycznej (dla gazów doskonałych o stałej pojemności cieplnej) wynosi: V Δ\ , J V W · DL · U U X · JDL · U U , J Przemiana izotermiczna, t = const. Z prawa Boyle’a i Mariotte’a: Praca bezwzględna: · · · · ]X Praca techniczna: · · ]X Ciepło przemiany izotermicznej (dla gazów doskonałych o stałej pojemności cieplnej) wynosi: V Δ\ , J, gdzie Δ\ 0, bo Δ^ 0. Przemiana adiabatyczna, (przemiana izentropowa), Q1-2 = 0. Przemiana izentropowa jest przemianą adiabatyczną, gdyŜ jej zewnętrzne ciepło przemiany jest takŜe równe zeru (Q=0). Dodatkowo w przypadku izentropy entropia przemiany jest niezmienna Δ` 0. Nie oznacza to, Ŝe kaŜda adiabata jest izentropą! Równanie Poissona: gdzie Q to wykładnik adiabaty. · N DaX`^, Dla adiabaty słuszne są następujące zaleŜności: N b c , U· N DaX`^ d N U b c , U 7 N N U Praca bezwzględna: DaX`^ b c d N N · · g1 b c Q1 Praca techniczna: Z Z , Q · Przemiana politropowa · i DaX`^, gdzie: j - wykładnik politropy. Dla politropy słuszne są następujące zaleŜności: i b c , U· i DaX`^ U . U d i i b c h i U b c , U U . U 1 · · · j1 · U · b1 c j1 U · i · e1 b c f j1 Praca techniczna: \ \ W · DL · U U 1 · · · Q1 · U · b1 c Q1 U · N · e1 b c f Q1 Praca bezwzględna: N N · · g1 b c j1 i i h j · . 8 Ciepło przemiany politropowej wynosi: V W · D · U U X · JD · U U . PoniewaŜ podczas przemiany politropowej zmienia się najczęściej objętość i ciśnienie czynnika, symbole c i (Mc) oznaczają ciepło właściwe politropy, obliczane według następujących zaleŜności: k jQ D DL DL · , j1 j1 jQ JD JDL · . j1 PARA WODNA Parametry pary nasyconej mokrej Stopień suchości pary nasyconej mokrej: #′′ #′′ l ′ ′′ , gdzie # # m# m’’- ilość pary nasyconej suchej, kg m’- ilość cieczy (w punkcie pęcherzyków), kg m – ilość pary nasyconej mokrej, kg Objętość właściwa pary nasyconej mokrej o stopniu suchości x: vx = v’ + x⋅(v” – v’), m3/kg. Entalpia właściwa pary nasyconej mokrej o stopniu suchości x: ix = i’ + x⋅(i” – i’), kJ/kg Dla wody o temp<150°C moŜna przyjąć, Ŝe <n o p, !q · &. Entropia właściwa pary nasyconej mokrej o stopniu suchości x: sx = s’ + x⋅(s” – s’), kJ/(kg K) Energia wewnętrzna właściwa pary nasyconej mokrej o stopniu suchości x: ux = u’ + x⋅(u” – u’) ux = ix – p⋅vx., kJ/kg 9 PRZEMIANY CHARAKTERYSTYCZNE PARY WODNEJ Przemiana izobaryczna, p=const. Praca absolutna przemiany Praca techniczna przemiany Ciepło przemiany gdzie: ∆Z Z Z s s W ∆\ \ \ t t W ∆` ` ` Przemiana izochoryczna, v=const. Praca absolutna przemiany Praca techniczna przemiany Ciepło przemiany Przemiana izotermiczna, t=const. Ciepło przemiany r r W, 0, V ∆Z , V ∆\ , V U∆` · W, J J J J J aktualne równieŜ dla przemian poniŜej =0, r W, V ∆Z , V ∆\ , V ∆Z , V ∆\ , V U∆` · W, J J J J J J J Przemiana adiabatyczna odwracalna = przemiana izentropowa, Q1-2=0, s=const. \ \u , Praca absolutna przemiany Praca techniczna przemiany Z Zu , J J Przemiana adiabatyczna nieodwracalna, Q1-2=0. Praca absolutna przemiany \ \ , Z Z , Praca techniczna przemiany J J Sprawność wewnętrzna maszyny przepływowej v Cw Cx Cw Cxy . 10