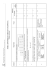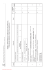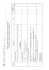odpowiedzi - arkuszmaturalny.pl
Transkrypt
odpowiedzi - arkuszmaturalny.pl
3 2 1 Zadanie Zam Kor Poziom rozszerzony C Wzór sumaryczny tlenku, w którym pierwiastek osiąga najwyższy stopień utlenienia – za poprawne uzupełnienie kolumny tabeli: Pierwiastek Liczba elektronów walencyjnych Liczba powłok elektronowych SrO X 2 5 CrO3 Y 6 4 – za napisanie równania reakcji: CO2 + 2NaOH → Na2CO3 + H2O lub CO2 + NaOH → NaHCO3 – za napisanie skróconej konfiguracji elektronowej: [He] 2s22p2 lub [He] 2s2p2 6 – za prawidłowe uzupełnienie schematu: 12 Odpowiedzi Al2O3 Z 3 3 Uwagi MODEL ODPOWIEDZI I SCHEMAT PUNKTOWANIA Egzamin maturalny z chemii. Poziom rozszerzony Copyright by ZamKor P. Sagnowski i Wspólnicy spółka jawna, Kraków 2011 3x1 1 2.1 3.1 1 1 1.2 1.1 za czynność Punktacja 3 1 za zadanie 2 1 7 6 5 4 Zam Kor 1 1 5.3 6.1 c) ZnO + 2OH– + H2O → [Zn(OH)4]2– lub inne prawidłowe określenie barw osadów 1 5.2 1 1 7.2 b) – za metodę – za obliczenia i wynik z jednostką: 0,103 dm3 np.: mtlenu = 2 g – 1,853 g = 0,147 g 32 g — 22,4 dm3 0,147 g — x x = 0,103 dm3 lub 217 g HgO — 22,4 dm3 O2 2 g HgO — x dm3 O2 x = 0,103 dm3 lub każda inna poprawna metoda 1 7.1 a) za napisanie równania reakcji: 2HgO → 2Hg + O2 lub HgO → Hg + ½O2 b) za podanie obserwacji: Zielonkawy osad Fe(OH)2 zmienia barwę na brunatną. 1 6.2 a) za wybór odczynnika: woda utleniona (H2O2) 1 5 wierszy – 3 pkt 3–4 wiersze – 2 pkt 2 wiersze – 1 pkt 0–1 wiersz – 0 pkt 5.1 bromek sodu miedź, grafit amoniak, bromek sodu Nazwy substancji azot, grafit amoniak 4.1 a) za uzupełnienie opisu doświadczenia: I. Na2[Zn(OH)4] II. ZnCl2 b) za poprawne uzupełnienie zdań: Doświadczenie I – Tlenek cynku zachowuje się jak tlenek kwasowy. Doświadczenie II – Tlenek cynku zachowuje się jak tlenek zasadowy. – za poprawne uzupełnienie wierszy tabeli: Warunek Mają wiązania kowalencyjne (atomowe) Mają wiązania kowalencyjne spolaryzowane (atomowe spolaryzowane) Mają budowę jonową Mogą przewodzić prąd elektryczny w stanie stałym Dobrze rozpuszczają się w wodzie Egzamin maturalny z chemii. Poziom rozszerzony Copyright by ZamKor P. Sagnowski i Wspólnicy spółka jawna, Kraków 2011 3 2 3 3 2 13 12 11 10 9 8 Zam Kor P/F F F P F NH4+ kwas NH4+ + H2O ⇄ NH3 + H3O+ – za określenie charakteru jonu i napisanie równania reakcji: Jon Teoria Brönstada (kwas, zasada) Równanie reakcji zasada S2– S2– + H2O ⇄ HS– + OH– – za podanie wzorów substancji zmieszanych w każdej z probówek: Probówka I A – Na2CO3 B – HCl lub odwrotnie Probówka II X – BaCl2 Y – MgSO4 lub odwrotnie Probówka III Z – NH4Cl W – NaOH lub odwrotnie – za napisanie jonowych równań reakcji: I. CO32– + 2H+ → CO2(↑) + H2O II. Ba2+ + SO42– → BaSO4(↓) III. NH4+ + OH– → NH3(↑) + H2O a) za identyfikację metali: X – Na (sód) Y – Ca (wapń) Z – Mg (magnez) b) za podanie uzasadnienia: np. (różna szybkość reakcji z wodą) wynika z różnych wielkości promieni atomowych lub różnej siły oddziaływań elektronów walencyjnych z jądrem atomowym lub różnej łatwości oddawania elektronów. a) za podanie obserwacji: Roztwór z oranżem metylowym zabarwił się na czerwono lub oranż metylowy zmienił zabarwienie z pomarańczowego na czerwone. b) za uzupełnienie ciągu przemian: O2 H 2O P4 P4O10 H3PO4 – za ocenę podanych zdań: Zdania Zmniejszenie ciśnienia obniża wydajność reakcji. Obniżenie temperatury nie wpływa na wydajność reakcji. Zwiększenie stężenia jodowodoru obniża wydajność reakcji. Użycie katalizatora zwiększa wydajność reakcji. Egzamin maturalny z chemii. Poziom rozszerzony Copyright by ZamKor P. Sagnowski i Wspólnicy spółka jawna, Kraków 2011 13.1 2x1 1 1 12.1 lub każda inna poprawna odpowiedź odpowiedź P2O5 nie będzie punktowana 12.2 1 1 3x1 11.2 11.1 10.1 3x1 4 poprawne odpowiedzi – 2 pkt 2–3 odpowiedzi – 1 pkt 0–1 odpowiedź – 0 pkt lub każde inne poprawne uzasadnienie należy uznać zapis równań reakcji bez (↑) lub (↓) 9.1 8.1 2 2 2 3 3 2 3 18 17 16 15 14 Zam Kor K =1, 7 ⋅10−2 10−3 α =1, 7% + H + c0 = czyli K = α ⋅ H α – za metodę – za obliczenia i wynik z jednostką: 33,3 kJ np.: ΔHx = ΔH02 – ΔH01 = 53,5 – 20 = 33,3 kJ α= K = α ⋅ c0 2 + −3 np.: pH = 3 ⇒ H =10 – za metodę – za obliczenia i wynik z jednostką: α = 1,7·10–2 lub α = 1,7% – za dobranie współczynników stechiometrycznych: Cr2O72– + 3CH3CH2OH + 8H+ → 2Cr 3+ + 3CH3CHO + 7H2O – za bilans elektronowy: Cr2O72– + 14H+ + 6e– → 2Cr 3+ + 7H2O | (x 1) CH3CH2OH → CH3CHO + 2H+ + 2e– | (x 3) b) za obliczenie SEM i podanie wyniku z jednostką: 0,26 V SEM = (Ek – Ea) = –0,14 + 0,40 = 0,26 V – za metodę – za obliczenia i wynik z jednostką: T = 30ºC np.: 18,7 g — 100 g roztworu ⇒ 81,3 g wody 18,7 g — 81,3 g wody x — 100 g x = 23 g ⇒ T = 30ºC a) za napisanie sumarycznego równania reakcji: Cd0 + Pb2+ → Cd2+ + Pb0 Egzamin maturalny z chemii. Poziom rozszerzony Copyright by ZamKor P. Sagnowski i Wspólnicy spółka jawna, Kraków 2011 VI III I lub każda inna poprawna metoda lub inna poprawna forma zapisu C → C + 2e x 3 −I Cr + 3e → Cr x 2 należy uznać również zapis: 18.1 17.1 1 1 1 1 1 1 16.1 16.2 1 1 1 1 15.2 15.1 14.1 2 2 2 2 2 4 22 21 20 19 Zam Kor 1 1 1 1 21.1 21.2 21.3 22.1 a) za napisanie równania reakcji: CH3 ─CH ═ CH─ CHO + Br2 → CH3 ─ CHBr─CHBr─CHO c) za określenie typu reakcji: addycja lub przyłączanie – za napisanie równania reakcji: NaC ≡CNa + 2H2O → 2NaOH + HC≡CH lub C2Na2 + 2H2O → 2NaOH + C2H2 b) za podanie obserwacji: Roztwór bromu odbarwia się lub zanika (pomarańczowe, brunatne) zabarwienie. 1 1 20.1 19.1 – za podanie wzoru produktu: CH3 ─ CH═ CH ─ COOH – za napisanie wzorów izomerów geometrycznych: Izomer cis Izomer trans H 3C CHO H3C H C ═C C═ C H H H CHO Egzamin maturalny z chemii. Poziom rozszerzony Copyright by ZamKor P. Sagnowski i Wspólnicy spółka jawna, Kraków 2011 1 3 1 1 5 25 24 23 Zam Kor kat. kat. + NaOH(aq) + CH3Cl Cl + Cl2 Cl CH3 OH + HCl + HCl + NaCl b) za napisanie równania reakcji: 2C15H31COO– + Ca2+ → (C15H31COO)2Ca (↓) b) za podanie nazw: 1. chlorobenzen 2. hydroksybenzen (fenol, benzenol) 3. metylobenzen – za podanie obserwacji: I. Białko ścina się, powstaje żółty osad. II. Zanika niebieski galaretowaty osad, tworzy się ceglasty osad. III. Zanika niebieski galaretowaty osad, powstaje klarowny szafirowy roztwór. a) za podanie obserwacji: I. Mydło rozpuszcza się, roztwór zabarwia się na malinowo, powstaje piana. III. Nie zachodzą żadne zmiany, roztwór nie zmienia barwy. 3 2 1 a) za napisanie równań reakcji: Egzamin maturalny z chemii. Poziom rozszerzony Copyright by ZamKor P. Sagnowski i Wspólnicy spółka jawna, Kraków 2011 należy uznać zapis równania reakcji bez (↓) 25.2 1 2x1 3x1 24.1 25.1 1 3x1 23.2 23.1 3 3 4 6 27 26 Zam Kor Nazwa grupy związków organicznych nitrozwiązki aminokwasy aminy estry NH2 + NH 3 Cl – NH2 NH 2� HCl lub CH3CHCOOH + HCl → CH3CHCOOH NH2 CH3CHCOOH + HCl → CH3CHCOOH NH2 CH3CHCOOH + NaOH → CH3CHCOONa + H2O – za napisanie równań reakcji: – za uzupełnienie tabeli: Związek organiczny nitrometan alanina metyloamina azotan(V) metylu Egzamin maturalny z chemii. Poziom rozszerzony Copyright by ZamKor P. Sagnowski i Wspólnicy spółka jawna, Kraków 2011 lub każdy inny poprawny zapis należy uznać odpowiedź: związki nitrowe, związki aminowe 27.1 26.1 2x1 1 2 1 7