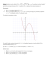Adres internetowy - T.Hofman HomePage
Transkrypt
Adres internetowy - T.Hofman HomePage
T. Hofman, © Wykłady z Termodynamiki, Wydział Chemiczny PW, kierunek: Biotechnologia, sem. letni 2015/2016 WYKŁAD 7-12. E. Konsekwencje zasad termodynamiki F. Odziaływania międzycząsteczkowe i równania stanu G. Opis równowag fazowych dla substancji czystych H. Formalistyka opisu układów wieloskładnikowych E. KONSEKWENCJE ZASAD TERMODYNAMIKI 44. Zarówno entropia jak i energia wewnętrzna stanowią przykład potencjałów termodynamicznych, czyli funkcji, których zmiany decydują o kierunku procesów w przyrodzie, przy stałości pewnych parametrów. Parametrami tymi dla entropii są (U,V), a dla energii wewnętrznej (S,V). Potencjały termodynamiczne określają również stan równowagi, ponieważ osiągają ekstremum (minimum albo maksimum) w tych warunkach. Inne potencjały termodynamiczne Entalpia (H) dH dw + pdV + Vdp + TdS = -(pz-p)dV + Vdp + TdS dla p=const=pz, S = const dH 0 Energia swobodna (F U - TS) dF dw - SdT = -pzdV - SdT dla V,T = const dF 0 Entalpia swobodna (G H - TS) dG dw + pdV + Vdp + -SdT = -(pz-p)dV + Vdp - SdT dla p=const=pz, T = const dG 0 Różniczki zupełne potencjałów termodynamicznych wynikają z różniczki zupełnej energii wewnętrznej (42.1) i otrzymuje się je poprzez wyeliminowanie dU na korzyść różniczki określonego potencjału. Z kolei związek pomiędzy tymi różniczkami podaje bezpośrednio definicja potencjału. Zestawienie właściwości potencjałów znajduje się w poniższej tabelce Potencjał różniczka zupełna względem parametrów (a) a b c d pochodne po parametrach (a) Entropia U,V (dS)U,V 0 rośnie max 1 p dS dU dV T T p 1 S S U V T V U T Energia wewnętrzna S,V (dU)S,V 0 maleje min dU = TdS - pdV U U T p S V V S Entalpia S,p (dH)S,p 0 maleje min dH = TdS +Vdp H T S p Energia swobodna T,V (dF)T,V 0 maleje min dF = -SdT - pdV F F S p V T T V S p V T T V Entalpia swobodna T,p (dG)T,p 0 maleje min dG = -SdT +Vdp G G V S T p p T S V p T p T H V p S relacje Maxwella T p V S S V T V p S S p (a) - parametry potencjału; (b) warunek, który musi być spełniony dla dowolnego procesu lub stany równowagi; (c) dla każdego spontanicznego procesu i stałości parametrów a, potencjał (rośnie lub maleje), (d) osiągając w stanie równowagi (maksimum albo minimum). 45. Pochodne entropii po temperaturze Z fenomenologicznej definicji entropii wynika dS dS p dQodw , co dla przypadków: izobarycznego i izochorycznego można napisać w postaci T dH p dU V ; dS V T T 15 T. Hofman, © Wykłady z Termodynamiki, Wydział Chemiczny PW, kierunek: Biotechnologia, sem. letni 2015/2016 lub dS p cp T dT ; dS V cV dT T co prowadzi do szukanych pochodnych cp S T p T c S ; V dT T V T Pochodne te, a szczególnie ta pierwsza, stanowią podstawę do eksperymentalnego wyznaczania entropii (ściślej zmian entropii). Oblicza się ją poprzez scałkowanie zależności temperaturowej eksperymentalnych pojemności cieplnych. 46. Wzajemne pochodne parametrów (p,V,T). Pochodne tę mają specjalne znaczenie ze względu na łatwość wyznaczania eksperymentalnego. Przedstawia się je zwykle w następującej postaci (izobaryczny) współczynnik rozszerzalności (temperaturowej) 1 V V T p (izotermiczny) współczynnik ściśliwości 1 V V p T współczynnik prężności p T V Można łatwo udowodnić, że współczynnik prężności nie jest niezależny, ale bezpośrednio wynika z dwóch pozostałych. A mianowicie, że = /. 47. W termodynamice statystycznej można wykazać, że najbardziej uporządkowany stan, w którym wszystkie cząsteczki znajdują na najniższym, podstawowym kwantowym poziomie energetycznym, odpowiada zerowej temperaturze. Odpowiada mu dokładnie jeden mikrostan energetyczny ( = 1) i zerowa entropia. Nie można tego stwierdzić na gruncie termodynamiki klasycznej, w związku z czym formułuje się III ZASADĘ TERMODYNAMIKI, która mówi Dla wszystkich faz skondensowanych i uporządkowanych lim S 0 T 0 Konsekwencje III Zasady: Zerowanie się entropii w granicy prowadzi do dążenia do zera również wszelkich zmian entropii dla temperatury zbliżającej się do zera bezwzględnego. Wynika z tego zerowanie pochodnych (S/p)T i (S/V)T , co z kolei (poprzez relacje Maxwella) prowadzi do tej samej granicy dla (V/T)p i (p/T)V. Na podstawie III Zasady można również udowodnić znikanie cp i cV dla temperatury T = 0. Eksperymentalnie wyznaczona entropia poprzez scałkowanie równania (49) czasami nie zgadza się z postulatem III Zasady. Wynika to z faktu, że często nie można w praktyce zrealizować wymogu odwracalnego oziębiania w zakresie bardzo niskich temperatur, w którym to gwałtownie spada szybkość wszelkich procesów, w tym procesu dochodzenia do stanu równowagi. W konsekwencji układ będzie wykazywał wyższą entropię (nosi ona nazwę entropii resztkowej) tak długo, dopóki nie dojdzie do stanu równowagi (co w praktyce może być nieosiągalne). 48. Rozpatrzmy równowagę w układzie wieloskładnikowym i wielofazowym. Dla uproszczenia niech układ składa się z dwóch (,) faz i k składników. Główny problem, który teraz się pojawi wynika z faktu, że jakkolwiek możemy założyć, że cały układ jest izolowany i zamknięty, to jednak poszczególne fazy układami zamkniętymi nie są, skoro dopuszcza się możliwość migracji (dyfuzji) cząsteczek poprzez granicę międzyfazową. Musimy zatem znaleźć wyrażenie na różniczkę zupełną jakiegoś potencjału termodynamicznego w funkcji także liczby moli. Wygodna będzie energia wewnętrzna U=U(S,V,n1,n2,...,nk). 16 T. Hofman, © Wykłady z Termodynamiki, Wydział Chemiczny PW, kierunek: Biotechnologia, sem. letni 2015/2016 k U U U dU dni dV dS V S ,ni S V ,ni i 1 ni S ,V ,n j i 48.1. Definicja potencjału chemicznego Dwie pierwsze pochodne są obliczane przy stałym składzie, a więc równają się: -p i T. Ostatni wyraz jest nowy, wyraża on zmiany energii wewnętrznej w wyniku zmiany liczby moli. Zdefiniujmy nowy parametr U i ni S ,V ,n j i który nazywa się potencjałem chemicznym. Umożliwia to zapisanie różniczki zupełnej energii wewnętrznej w postaci k dU pdV TdS i dni i 1 Potencjał chemiczny jest niezwykle ważnym parametrem intensywnym, który ma charakter siły uogólnionej odpowiadającej zmianom energii związanym ze zmianami liczby cząsteczek (moli). Łatwo można wykazać, że równy jest on odpowiedniej pochodnej każdego potencjału termodynamicznego, tj. . U H F G n n n i S ,V ,n ji i S , p ,n ji i T ,V ,n ji ni T , p ,n ji i Zwykle jednak opiera się potencjał chemiczny na entalpii swobodnej, a to między innymi dlatego, że dla czystej substancji równa się on molowej entalpii swobodnej, tj. = Gm. Analogiczne zależności nie zachodzą dla innych potencjałów termodynamicznych. Różniczka zupełna entalpii swobodnej w układzie otwartym będzie równa k G G G dp dG dni dT T p ,ni i 1 ni T , p ,n p T ,ni j i 48.2. Przyjmijmy, że cały układ jest izolowany U,V,N = const U = U + U V = V+V N = N+N W stanie równowagi, entropia całego układu + musi osiągnąć maksimum. Jej różniczka zupełna równa się dS dS dS 1 p 1 dU dV T T T k i 1 i dni 1 p 1 k dU dV i dni 0 T T T i 1 Ponieważ układ jako całość jest zamknięty, ni+ ni = Ni = const i dni+ dni =0; U + U = U = const i dU + dU = 0 oraz V+V = V = const i dV + dV = 0. Oznacza to, że niezależnymi parametrami są tylko te, które odnoszą się do jednej fazy, czyli k p p 1 1 dS dU dV i i dni 0 T T T T T i 1 T Warunkiem koniecznym istnienia minimum funkcji wielu zmiennych jest zerowanie się pierwszych pochodnych cząstkowych. Zatem wszystkie różnice muszą równać się zeru. Prowadzi to do następującego warunku równowagi: 49. Warunek równowagi w układzie wieloskładnikowym i wielofazowym p = p = p = ... = p (po wszystkich fazach) T = T = T = ... = T i = i = i = ... = i (dla każdego składnika i = 1,2,3,...k) 17 T. Hofman, © Wykłady z Termodynamiki, Wydział Chemiczny PW, kierunek: Biotechnologia, sem. letni 2015/2016 Przykład: Rozpatrzmy układ trójfazowy, zawierający roztwór wodny KCl (c), kryształy soli (s), oraz fazę gazową (g), zawierającą powietrze i parę wodną. Rozpuszczalność powietrza (tlenu i azotu) w roztworze można pominąć. W stanie równowagi, poza stałością ciśnienia i temperatury dla całego układu, będą spełnione następujące związki pomiędzy potencjałami chemicznymi: s c KCl KCl Hc O Hg O 2 2 Zerowanie się pierwszych pochodnych cząstkowych daje warunek konieczny a nie dostateczny. I to istnienia ekstremum a nie minimum. W związku z tym muszą być spełnione dodatkowe kryteria, które wynikają z zachowania się macierzy drugich pochodnych. Noszą one nazwę warunków stabilności i niektóre z nich dla układu wieloskładnikowego są dość skomplikowane. Dwa najbardziej podstawowe, które muszą być spełnione przez każdą z faz, to: warunek stabilności termicznej: warunek stabilności mechanicznej: cV 0 V 0 p T Ten pierwszy wynika z żądania, aby druga pochodna entropii po energii wewnętrznej była mniejsza od zera. Pierwsza pochodna (patrz 48.2), równa się 1 1 S U T T Z kolei druga pochodna będzie wynosić 2 S 1 T 1 T 1 1 2 2 2 2 0 2 T U V T U V T cv T cv U Ostateczną nierówność można zapisać w postaci 1 1 0 T 2 cv T 2 cv co dla substancji czystej, dla której cv cv cv , prowadzi do cV 0. 50. Warunek równowagi w układzie wielofazowym i wieloskładnikowym mówi o pewnych związkach matematycznych, które muszą zaistnieć pomiędzy parametrami faz współistniejących w stanie równowagi. Istnienie tych relacji sprawia, że liczba parametrów niezależnych (nazywane są stopniami swobody układu) jest mniejsza od liczby wszystkich parametrów. Oznacza to, że określenie tylko niektórych spośród nich wystarcza do opisu układu w stanie równowagi - wartości pozostałych parametrów wynikają bowiem jednoznacznie z matematycznego warunku równowagi. Nie ma znaczenia, jakie parametry uzna się za niezależne, a jakie za zależne jednoznacznie określona jest jedynie liczba tych pierwszych jak i drugich. Warto zwrócić uwagę, że wszystkie parametry występujące bezpośrednio w warunkach równowagi (ciśnienie, temperatura, potencjały chemiczne), są parametrami intensywnymi. Tak więc wielkość układu nie wpływa na położenie stanu równowagi i do jej opisu wystarczą parametry intensywne właśnie ciśnienie, temperatura i zamiast liczby moli poszczególnych składników w każdej z faz - stężenia. Te ostatnie w termodynamice przedstawia się zwykle poprzez ułamki molowe xi ni n i oczywiście x j 1 j Niech rozważany układ składa się z f faz i n składników. Liczba parametrów (po uwzględnieniu stałości p i T) opisujących układ wynosi liczba parametrów = 2 + f(n-1) [T,p + ułamki molowe dla każdej z faz] liczba równań wiążących te parametry = n(f-1) [równość potencjałów chemicznych] Stąd liczba parametrów niezależnych (stopni swobody układu - ) równa się = 2 + f(n-1) - n(f-1) = n + 2 - f 18 T. Hofman, © Wykłady z Termodynamiki, Wydział Chemiczny PW, kierunek: Biotechnologia, sem. letni 2015/2016 równanie to nosi nazwę reguły faz (Gibbsa) Jeśli w układzie występują jeszcze inne, dodatkowe warunki w liczbie k (np. warunek elektroobojętności, równowaga chemiczna), to reguła faz musi być zmodyfikowana do = n+2 -f-k Ile maksymalnie faz może istnieć we wzajemnej równowadze w układzie n-składnikowym? Liczba faz równa się f = n + 2 - , przy czym wartość maksymalną uzyskuje się dla minimalnej liczby stopni swobody równej zero. Stąd fmax = n + 2 Tak więc dla substancji czystej mogą istnieć maksymalnie trzy fazy w równowadze. Stan taki nazywa się punktem potrójnym. Zero stopni swobody oznacza, że wartości wszystkich parametrów są jednoznacznie określone. Zmiana jakiegokolwiek z nich spowoduje, że układ przestanie być trójfazowy. Najczęściej spotykany punkt potrójny dotyczy równowagi (ciecz - para - ciało stałe), ale w przypadku występowania różnych odmian polimorficznych czy alotropowych w fazie stałej możliwe jest współistnienie również innych faz. Trudno przecenić zasługi dla współczesnej termodynamiki fizyka amerykańskiego, Jossiaha Willarda Gibbsa (1839-1903). Jemu zawdzięczamy ścisły i obecnie używany wywód termodynamiki klasycznej (szczególnie koncepcję potencjałów chemicznych i termodynamiczny opis układów wieloskładnikowych), jak również zdefiniowanie podstaw termodynamiki statystycznej. To od Gibbsa pochodzi idea określania wartości parametrów makroskopowych poprzez uśrednianie po zespole statystycznym. Podstawowy potencjał termodynamiczny - entalpia swobodna, nazywana bywa również funkcją albo energią Gibbsa. Stąd też pochodzi litera "G" na oznaczenie tej funkcji. Jego nazwisko będzie się jeszcze wielokrotnie pojawiać w wielu prawach termodynamicznych. 51. Konsekwencje I i II zasady termodynamiki – niektóre tożsamości i opisy procesów. 51.1. Jak energia wewnętrzna zależy od objętości w stałej temperaturze? Rozwiązanie tego problemu sprowadza się do znalezienia wyrażenia na pochodną (U/V)T. Ponieważ (V,T) są parametrami charakterystycznymi energii swobodnej (F), wygodnie będzie przedstawić U jako funkcję F. U = F + TS stąd U F S T V T V T V T Pierwsza pochodna równa się -p a druga (z relacji Maxwella) wynosi (p/T)V (46). Stąd otrzymamy wyrażenie na szukaną pochodną w funkcji parametrów bezpośrednio mierzalnych - p,V,T. U p p T V T T V Równanie to nosi nazwę termodynamicznego równania stanu. Dla gazu doskonałego pochodna ta równa się nR nRT nRT nRT p U p 0 p V V V T V V V T A zatem energia wewnętrzna gazu doskonałego nie zależy od objętości (i w związku z tym nie zależy również od ciśnienia dlaczego (?)). Zależy jedynie od temperatury. To wynik, którego oczekiwaliśmy. Przecież niezależność energii wewnętrznej od objętości wynika bezpośrednio z założeń molekularnych, na podstawie których wyprowadza się równanie stanu gazu doskonałego. To samo stwierdzenie można zastosować do entalpii, ponieważ dla gazu doskonałego różnica pomiędzy energią wewnętrzną a entalpią zawiera się w składniku nRT (dlaczego?), zależnym tylko od temperatury. Dla gazu spełniającego równanie van der Waalsa, wobec nRT an2 V nb V 2 nR p T V V nb p 19 T. Hofman, © Wykłady z Termodynamiki, Wydział Chemiczny PW, kierunek: Biotechnologia, sem. letni 2015/2016 otrzymujemy nRT nRT an 2 nRT an 2 U 2 2 p V nb V nb V V nb V V T 51.2. Związek pomiędzy współczynnikami ściśliwości, rozszerzalności i prężności (,,). Przedstawmy różniczkę zupełną V(T,p). V V dp VdT Vdp dV dT T p p T stąd wyznaczamy dp dp 1 dT dV V otrzymując różniczkę zupełną p(T,V). Wyraz wymnożony przez dT jest pochodną (p/T)V, czyli współczynnikiem prężności. A zatem mamy = / 51.3. Związek pomiędzy cp i cV. Korzystając z definicji entalpii H = U + pV, otrzymujemy H U V cp p T p T p T p Pochodną (U/T)p znajdziemy wyrażając różniczkę zupełną U(T,p), ale poprzez różniczkę zupełną U(T,V), ponieważ w naszym wyrażeniu musi się znaleźć cV =(U/T)V. U U U dU T ,V dT dV cV dT dV T V V T V T z drugiej strony dV można wyrazić jako funkcję p i T V V dp dV T , p dT T p p T Po podstawieniu do poprzedniego równania otrzymamy V U V U V U V dp cV dp dU T , p dU cV dT dT dT V T T p V T T p V T p T p T Uzyskaliśmy ostatecznie różniczkę zupełną U(T,p) i szukana pochodna (U/T)p jest wyrazem wymnożonym przez dT. U U V V p cV cV p T T p V T T p T p T V I ostatecznie podstawiając do pierwszego równania V p V V c p cV p T p T p T V T p T p p V c p cv T T V T p 20 T. Hofman, © Wykłady z Termodynamiki, Wydział Chemiczny PW, kierunek: Biotechnologia, sem. letni 2015/2016 Sprawdźmy, że rzeczywiście dla gazu doskonałego będziemy mieć cp = cV + nR F. ODZIAŁYWANIA MIĘDZYCZĄSTECZKOWE I RÓWNANIA STANU 52. Opis właściwości gazu za pomocą równania stanu gazu doskonałego jest niezwykle atrakcyjny z powodu prostoty równania i jego poprawności teoretycznej w ramach przyjętych założeń molekularnych. Czy jednak założenia te są zgodne z rzeczywistością? I tak, i nie. Tak, bo wszystkie gazy zachowują się jak gazy doskonałe w granicy dla p 0, równanie stanu gazu doskonałego jest zatem prawem granicznym. Nie, bo w miarę wzrostu ciśnienia, odchylenia od rzeczywistych właściwości stają się coraz poważniejsze. Podstawowa nieadekwatność równania stanu gazu doskonałego daje się zauważyć w obszarze występowania równowagi ciecz-para i samej fazy ciekłej. W fazie tej występują bardzo silne oddziaływania międzycząsteczkowe, które są przecież całkowicie pomijane w modelu gazu doskonałego. Dobrym parametrem będącym miarą odchyleń od doskonałości jest ściśliwość (współczynnik kompresji) definiowany jako Z pV nRT Nazwa może wydawać się niefortunna, bo nasuwa skojarzenia ze współczynnikiem ściśliwości ( ). Są to jednak zupełnie różne parametry. Dla gazów, w miarę wzrostu ciśnienia, począwszy od p = 0, ściśliwość maleje poniżej jedności aż do minimum, a następnie zaczyna rosnąć, znacznie przekraczając tę wartość. Taki przebieg tłumaczony jest charakterem oddziaływań międzycząsteczkowych, które dla większych odległości są przyciągające, ale przy dużych wzajemnych zbliżeniach cząsteczek stają się zdecydowanie odpychające. Dokładna zależność energii oddziaływania pary cząsteczek w funkcji wzajemnej odległości wymaga przeprowadzenia skomplikowanych obliczeń kwantowomechanicznych. W praktyce jednak do jej opisu zwykle używa się półempirycznych funkcji, przybliżających rzeczywiste zależności. Najczęściej spotykaną formą jest potencjał Lennarda-Jonesa, który zakłada następującą energię potencjalną () w funkcji odległości pomiędzy dwiema cząsteczkami (r). 5 4 3 odp 2 Zależność współczynnika kompresji od ciśnienia (D.P.Tassios, Applied Chemical Engineering Thermodynamics, Springer-Verlag, 1993) 1 r 21/6 0 -1 Potencjał Lennarda-Jonesa przyc -2 0.5 1.0 1.5 r/ 2.0 2.5 3.0 12 6 4 r r 53. Równanie stanu van der Waalsa an2 p 2 V nb nRT V Parametry a i b powinny być niezależne od temperatury i ciśnienia. Pierwszy z nich (a) jest miarą oddziaływań międzycząsteczkowych, drugi (b) stanowi poprawkę na niezerową objętość cząsteczek. Z przebiegu izoterm (tj. p = f(V,T=const)) można wywnioskować istnienie obszaru niestabilności dla T < Tk. Powyżej tej temperatury izotermy są malejące w całym zakresie objętości. Obszar niestabilności odpowiada występowaniu fazy ciekłej i fazy gazowej w równowadze. W obszarze tym ciśnienie musi być stałe (co wynika z reguły faz) i pojawiają się dwie wartości objętości, które odpowiadają cieczy i parze. W obszarze dwufazowym izotermę (która jest funkcją stałą) konstruuje się zgodnie z zasadą równych pól Maxwella. Reguła ta wymaga, aby pola ograniczone wykresem analitycznej izotermy, leżące ponad i poniżej wspomnianej funkcji stałej, były równe. 21 T. Hofman, © Wykłady z Termodynamiki, Wydział Chemiczny PW, kierunek: Biotechnologia, sem. letni 2015/2016 W punkcie maksymalnym obszaru dwufazowego, zanika różnica pomiędzy fazą ciekłą i gazową. Objętości obu faz zbiegają się do jednego punktu. Stan taki, któremu odpowiadają określone wartości temperatury, ciśnienia i objętości, nazywa się stanem krytycznym, a parametry stan ten opisujące - parametrami krytycznymi. Powyżej temperatury krytycznej istnieje tylko jedna faza, zwana gazem lub płynem nadkrytycznym. 350 700 K 300 700 K 300 650 K izotermy van der Waalsa dla wody. (po lewej) – postać matematyczna (po prawej) – izotermy skorygowane na obecność równowagi ciecz-para p/bar 600 K 100 550 K 250 650 K 200 p/bar 200 600 K 150 0 550 K 100 500 K -100 500 K 50 -200 0 0.00 0.20 0.40 V/dm3.mol-1 0.60 0.80 0.00 0.20 0.40 0.60 V/dm3.mol-1 Punkt krytyczny w sensie matematycznym stanowi płaski punkt przegięcia na wykresie izotermy, w związku z czym musi spełniać poniższe warunki 2 p p 0 2 0 V T V T Obliczając powyższe pochodne dla równania van der Waalsa otrzymuje się RT 2a p 0 (V b) 2 V 3 V T 2 p 2 RT 6a 2 4 0 3 V T (V b) V z czego można wyznaczyć parametry krytyczne w funkcji współczynników a, b równania van der Waalsa. Tk 8a 27Rb pk a 27b 2 Vk 3b (ten ostatni parametr jest objętością molową) Wynikająca z tych wzorów ściśliwość krytyczna wynosi Tk pkVk 3 0,375 RTk 8 i taką wartość zgodnie z modelem van der Waalsa powinny wykazywać wszystkie gazy. W rzeczywistości jednak eksperymentalne ściśliwości krytyczne zmieniają się w przybliżeniu w granicach 0,25 < Zk < 0,30, a więc znacznie poniżej wartości przewidywanej przez równanie van der Waalsa. Trzeba podkreślić, że równanie van der Waalsa jest modelem bardzo uproszczonym, prowadzącym do dużych błędów zarówno w obszarze krytycznym, w opisie fazy ciekłej i prężności pary nasyconej. Niemniej jednak jest to najprostsze równanie stanu, przewidującej jakościowo występowanie równowagi ciecz-para i stanu krytycznego. Równania stanu stosowane współcześnie do opisu właściwości gazów, płynów nadkrytycznych i (rzadziej) cieczy, zwykle opierają się na równaniu Redlicha-Kwonga będąc jakąś jego modyfikacją. Oryginalne równanie Redlicha-Kwonga ma następującą postać dla jednego mola gazu a p T 1/ 2V (V b) (V b) RT 22 0.80 T. Hofman, © Wykłady z Termodynamiki, Wydział Chemiczny PW, kierunek: Biotechnologia, sem. letni 2015/2016 Przewiduje ono ściśliwość krytyczną równą Zk = 1/3. Dalsze formy uwzględniają zależność temperaturową wyrażenia a/T1/2, w której pojawiają się parametry wyznaczone metodami regresji. Do najczęściej stosowanych należą równania: SRK (Soave-Redlich-Kwong) i Penga-Robinsona. 54. Wykonując procedurę odwrotną do przedstawionej w poprzednim punkcie, można wyrazić współczynniki równania van der Waalsa a, b poprzez parametry krytyczne. Wtedy a 3Vk2 pk b Vk 3 Dodatkowo jeszcze przedstawiając stałą gazową jako R (relacja ta wynika z faktu, że 8 pkVk 3Tk Zk pkVk 3 RTk 8 ) można otrzymać równanie van der Waalsa, w którym zamiast a i b, współczynnikami są parametry krytyczne. Najwygodniejsza forma nosi nazwę zredukowanego równania van der Waalsa 3 pr 2 3Vr 1 8Tr Vr gdzie parametry oznaczone indeksem "r" noszą nazwę parametrów zredukowanych i są zdefiniowane jako Tr T Tk pr p pk Vr V Vk Można mówić zatem o temperaturze, ciśnieniu i objętości zredukowanej. Istnienie zredukowanej formy równania stanu ma duże znaczenie praktyczne, ponieważ umożliwia opis właściwości gazu na podstawie tylko kilku szczególnych wartości - w tym przypadku parametrów krytycznych. 55. Równanie wirialne stanu Otrzymuje się je poprzez rozwinięcie ściśliwości w szereg względem (1/V) 2 1 1 Z 1 B C .... V V gdzie B jest drugim współczynnikiem wirialnym, C - trzecim, itd. albo też względem ciśnienia (p) Z = 1 + Bp + Cp2 + ... Współczynniki wirialne obu form rozwinięcia nie są takie same, chociaż są ściśle ze sobą powiązane. Wszystkie one są funkcją tylko temperatury. Przy ograniczeniu szeregu tylko do drugiego współczynnika (takie równanie określa się jako równanie wirialne obcięte do drugiego współczynnika), otrzymuje on szczególnie dogodną formę pVm = RT + RTB'p lub częściej pVm = RT + Bp przy czym współczynnik B (nazywany jest również drugim współczynnikiem wirialnym) równa się iloczynowi współczynika z poprzedniego równania i wyrażenia RT. Drugi współczynnik wirialny (zdefiniowany powyżej) jest silną funkcją temperatury. W temperaturze T = TB, zwanej temperaturą Boyle'a, drugi współczynnik wirialny równa się zeru i z punktu widzenia niektórych właściwości, gaz zachowuje się jak gaz doskonały. 23 T. Hofman, © Wykłady z Termodynamiki, Wydział Chemiczny PW, kierunek: Biotechnologia, sem. letni 2015/2016 G. OPIS RÓWNOWAG FAZOWYCH DLA SUBSTANCJI CZYSTYCH 56. Związek pomiędzy ciśnieniem a temperaturą w równowagach fazowych substancji czystych. Z reguły faz wynika, że dla układu jednoskładnikowego mogą wystąpić w równowadze dwie lub trzy fazy. W tym drugim przypadku układ ma zero stopni swobody i wszystkie parametry stanu równowagi (tj. T, p) są ściśle określone. Dla dwóch faz w równowadze układ ma jeden stopień swobody i tylko jeden parametr jest niezależny, drugi wynika z wartości tego pierwszego. Znajdźmy funkcję wiążącą p i T dla tego przypadku. Związek pomiędzy parametrami w stanie równowagi wynika z warunku T , p T , p Termodynamika klasyczna nie jest w stanie wyprowadzić bezpośrednio szukanej zależności pomiędzy potencjałem chemicznym a ciśnieniem i temperaturą. Jej rola sprowadza się do stwierdzenia istnienia określonych funkcji i związków pomiędzy nimi. Podaje także wyrażenia na zmiany tychże funkcji. Wykorzystajmy to ostatnie stwierdzenie, stawiając problem w sposób następujący: Dla określonych wartości T i p układ jest w stanie równowagi pomiędzy fazami i . Zmieniono jeden z parametrów od dT (albo o dp). Jak musi zmienić się drugi parametr, aby układ pozostał w stanie równowagi? Aby tak było, zmiana obu potencjałów chemicznych musi być taka sama, aby równość pomiędzy nimi była zachowana. Daje to relację w postaci d T , p d T , p O opisanym procesie mówi się, że zachodzi po linii równowagi. Potencjał chemiczny substancji czystej równa się molowej entalpii swobodnej (patrz uwaga do 48.1), zatem można zapisać powyższe równanie jako dGm T , p dGm T , p Podstawiając różniczki zupełne entalpii swobodnej w funkcji parametrów charakterystycznych (44), otrzymuje się S m dT Vm dp S m dT Vm dp dp S m S m dT Vm Vm Różnice po prawej stronie są molowymi zmianami entropii i objętości dla procesu przemiany fazowej w warunkach równowagowych i można oznaczyć je w zwykły sposób S p T V eq Indeks "eq", oznacza zachodzenie procesu w stanie równowagi, co tożsame jest warunkowi = , czasami używa się indeksu „sat” werbalizowanemu jako „po nasyceniu”.. Ponieważ dla procesu równowagowego pod stałym ciśnieniem i w stałej temperaturze S Q H T T (dlaczego ?) zwykle wyraża się entropię przemiany poprzez zmianę entalpii, otrzymując ostateczny wzór H p T T V eq Równanie to nosi nazwę RÓWNANIA CLAPEYRONA. Równanie Clapeyrona wiąże ciśnienie z temperaturą dla równowagi pomiędzy dwiema fazami substancji czystej i jest ścisłe termodynamicznie. To znaczy, że każda równowaga czy przemiana fazowa (pierwszego rodzaju - patrz wyjaśnienie poniżej) musi spełniać to równanie. Niestety, jego charakter różniczkowy sprawia, że aby otrzymać bezpośrednio funkcję p = f(T) należy dokonać 24 T. Hofman, © Wykłady z Termodynamiki, Wydział Chemiczny PW, kierunek: Biotechnologia, sem. letni 2015/2016 całkowania, a to z kolei wymaga przyjęcia założeń upraszczających co do zależności temperaturowej (lub ciśnieniowej) zarówno H jak i V. Przemiany fazowe, które opisuje równanie Clapeyrona noszą nazwę przemian pierwszego rodzaju. Charakteryzują się one skokową zmianą kolejnych pochodnych entalpii swobodnej po ciśnieniu i temperaturze, począwszy od pierwszej pochodnej (tj. entropii i objętości). Dla przemian drugiego rodzaju, nie ma nieciągłości entropii i objętości, ale pojawia się zmiana drugich i wyższych pochodnych (tj. np. cV , i ). Dla tego typu równowagi, prawa strona równania Clapeyrona jest nieokreślona (0/0). Równanie wiążące p i T dla równowagi drugiego rodzaju, nosi nazwę równania Ehrenfesta. 57. Równowaga ciecz-para i ciało stałe-para. 1. Równowaga ciecz-para (równowaga parowania) Równanie Clapeyrona przybierze postać H par p T T V par eq Ponieważ dla procesu parowania zawsze Hpar > 0 (dlaczego? - analizę przeprowadza się analizując znak entropii parowania) i Vpar > 0, pochodna (p/T)sat jest zawsze dodatnia i wzrost ciśnienia będzie powodował podwyższenie temperatury wrzenia. Albo, co jest tożsame, wzrost temperatury wrzenia podwyższy prężność pary nasyconej. Najprostszy zestaw założeń upraszczających umożliwiających scałkowanie równania Clapeyrona jest następujący: a. Entalpia parowania nie jest funkcją temperatury (i w związku z tym i ciśnienia). b. Faza gazowa jest gazem doskonałym, czyli jej objętość molowa wyraża się wzorem Vmg RT p c. Objętość fazy ciekłej jest znacznie mniejsza od objętości fazy gazowej i może być pominięta. Umożliwia to zastąpienie zmiany objętości poprzez objętość pary V par Vmg Vmc RT p Po podstawieniu do równania Clapeyrona otrzymamy pH par p RT 2 T eq dp H par dT p RT 2 i po scałkowaniu H par 1 1 p ln 2 R T2 T1 p1 lub też wykorzystując całkę nieoznaczoną ln p H par RT C Jest to równanie Clausiusa-Clapeyrona i stanowi ono przykład zależności zwanej krzywą parowania. Bezpośrednim wnioskiem z niego wypływającym jest liniowa zależność logarytmu prężności pary nasyconej od odwrotności temperatury i związek współczynnika kierunkowego tej prostej z entalpią parowania. Równanie Clausiusa-Clapeyrona jest równaniem przybliżonym. Jego dokładność wynika z wiarygodności założeń upraszczających (a,b,c). Spośród nich najdalej idącym jest założenie o niezależności temperaturowej entalpii parowania. W 25 T. Hofman, © Wykłady z Termodynamiki, Wydział Chemiczny PW, kierunek: Biotechnologia, sem. letni 2015/2016 rzeczywistości entalpia parowania jest wyraźną funkcją temperatury i maleje do zera podczas gdy temperatura zbliża się do temperatury krytycznej. Dla warunków odległych od krytycznych zależność ta staje się mniej wyraźna i wtedy przyjęte założenie jest bardziej uzasadnione. Niemniej jednak równanie Clausiusa-Clapeyrona stosuje się jedynie dla niezbyt dużych różnic temperatury. Zauważmy jeszcze, że równanie Clausiusa-Clapeyrona w oczywisty sposób zawodzi w warunkach bliskich stanowi krytycznemu, ze względu na niedopuszczalność założenia (c). Względna niedokładność tego równania sprawia, że w praktyce stosuje się jego empiryczne modyfikacje. Najbardziej rozpowszechnione jest równanie Antoine'a ln p A B T C 2. Równowaga ciało stałe-para (równowaga sublimacji) Równanie Clapeyrona będzie miało postać H sub p T eq TVsub Bezpośrednie scałkowanie opiera się na założeniach analogicznych do (58.1a-c). Duża odległość od stanu krytycznego sprawia, że kwestionowane założenia a i c, są znacznie bardziej wiarygodne dla równowagi sublimacji niż parowania. Wynikające związki mają formę równania Clausiusa-Clapeyrona p H sub 1 1 ln 2 p R T2 T1 1 H sub ln p C RT 58. Równowaga pomiędzy fazami skondensowanymi. Rozważmy to zagadnienie na przykładzie procesu topnienia. Z równania Clapeyrona mamy H top p T eq TVtop Ponieważ Htop > 0, o jakościowym wpływie ciśnienia na temperaturę topnienia decyduje znak Vtop. Dla zdecydowanej większości ciał prawdziwe jest Vtop> 0 i wzrost ciśnienia powoduje podwyższenie temperatury topnienia. Istnieją jednak nieliczne substancje (np. woda), dla których Vtop< 0 i wtedy obserwowany efekt jest przeciwny. Przy całkowaniu równania Clapeyrona, zwykle zakłada się niezależność od ciśnienia (temperatury) entalpii topnienia i zmiany objętości topnienia. Założenie to uzasadnione jest ogólną obserwacją, że właściwości faz skondensowanych w małym stopniu zależą od ciśnienia. A zatem dp H top dT Vtop T skąd otrzymuje się bezpośrednio równanie krzywej topnienia p2 p1 H top Vtop ln T2 T1 lub p H top Vtop ln T C Bardzo stromy charakter krzywej topnienia sprawia, że jej krzywizna jest nieznaczna i równie dobrym przybliżeniem jest równanie p H top T TVtop 26 T. Hofman, © Wykłady z Termodynamiki, Wydział Chemiczny PW, kierunek: Biotechnologia, sem. letni 2015/2016 w którym pochodna lewej strony została zastąpiona przez iloraz różnicowy. Podobny charakter mają krzywe przemian alotropowych i polimorficznych w fazie stałej. Zmiany entalpii i objętości odnoszą się wtedy do konkretnej przemiany. 59. Diagramy fazowe substancji czystych. Diagram fazowy we współrzędnych p,T,V wg S. Stølen, T. Grande, N.L. Allan, Chemical Thermodynamics of Materials, J. Wiley & Sons, Ltd, 2004 27 T. Hofman, © Wykłady z Termodynamiki, Wydział Chemiczny PW, kierunek: Biotechnologia, sem. letni 2015/2016 H. FORMALISTYKA OPISU UKŁADÓW WIELOSKŁADNIKOWYCH 60. Sposoby wyrażania potencjału chemicznego jako funkcji p,T i xi. Znalezione funkcje będą zawsze przedstawiać jedynie różnice wartości potencjałów pomiędzy stanem aktualnym a jakimś stanem odniesienia. Jest to konsekwencją definiowania funkcji termodynamicznych poprzez ich różniczki. 1. Potencjał chemiczny gazu doskonałego. Znalezione funkcje będą zawsze przedstawiać jedynie różnice wartości potencjałów pomiędzy stanem aktualnym a jakimś stanem odniesienia. Jest to konsekwencją definiowania funkcji termodynamicznych poprzez ich różniczki. Dla czystego gazu mamy = Gm i wobec Gm RT Vm p p T otrzymujemy d RT dp p I po scałkowaniu T , p 0 T , p 0 RT ln p p0 Ciśnienie odniesienia p° może być dowolne, ale wygodnie jest przyjąć wartość standardową równą 1 bar. Dla każdego składnika w mieszaninie gazów doskonałych można udowodnić, że i T , p i0 T , p 0 RT ln pi p0 gdzie pi = pxi jest ciśnieniem cząstkowym składnika i a i°(T,p°) wyraża potencjał chemiczny czystego składnika pod ciśnieniem p°. Wyraz RTln(pxi/p°) jest zmianą potencjału chemicznego przy izotermicznym przejściu od czystego składnika pod ciśnieniem p° do mieszaniny o składzie xi i pod sumarycznym ciśnieniem p. Wartości potencjału chemicznego dla poszczególnych stanów wspomnianego wyżej procesu przedstawiają się następująco czysty gaz (p°) i°(T,p°) składnik mieszaniny (xi,p) czysty gaz (p) 1 RTln(p/p°) i°(T,p) 2 i(T,p) RTlnxi Kluczowe znaczenie ma element 2. Jego wartość wynika ze spostrzeżenia, że różnica potencjałów będzie równa zmianie potencjału dla czystej substancji, przy zmianie ciśnienia od p do pxi, ponieważ to ostatnie ciśnienie będą wywierały cząsteczki składnika i po zmieszaniu. 2. Potencjał chemiczny wyrażony poprzez lotności. Jeśli chce się zachować formę potencjału dla gazu doskonałego i stosować ją do układów rzeczywistych, wymaga to pewnej modyfikacji. W tym celu zastępuje się ciśnienie cząstkowe nowym parametrem zwanym lotnością (fi). i T , p i0id T , p 0 RT ln fi p0 Stanem odniesienia jest czysty gaz doskonały pod ciśnieniem standardowym (p°= 1 bar). Przyjęcie takiego stanu odniesienia implikuje warunek lim f i pi p 0 jako że powyższe równanie musi przechodzić w wyrażenie na potencjał gazu doskonałego w granicy dla p 0. 28 T. Hofman, © Wykłady z Termodynamiki, Wydział Chemiczny PW, kierunek: Biotechnologia, sem. letni 2015/2016 Formalnie lotność definiuje za pomocą różniczki zupełnej potencjału chemicznego w stałej temperaturze. tj. di)T = RTdlnfi)T i przy spełnionym warunku granicznym fi pi dla p 0, który określa stałą całkowania. Często lotność przedstawia się jako iloczyn ciśnienia cząstkowego i współczynnika lotności (i). Wtedy fi = pii. Ścisła definicja współczynnika lotności to i fi pi i i 1 dla p0 Lotność (lub współczynnik lotności) stosuje się głównie do opisu właściwości gazów, ale można ją obliczyć dla dowolnego stanu skupienia. Współczynnik lotności może być uważany za miarę odchyleń od stanu gazu doskonałego. Dla gazu doskonałego i = 1 i wszelkie odstępstwa od tej wartości wskazują na niedoskonałości. Jak obliczyć lotność na podstawie równania stanu? Zauważmy, że z zapisu pxi RT ln i 0 p i T , p i0,id T , p 0 RT ln wynika następujące wyrażenie na współczynnik lotności RT ln i i T , p iid T , p Różniczkując obustronnie po ciśnieniu w stałej temperaturze, uzyskamy ln i i iid RT p T p T p 2G 2G id 2G 2G id T ni p ni p pni pni V V id ni p ,T ,n j ni Vi Vi id p ,T ,n j (pochodna oznaczona jako Vi nazywa się objętością molową cząstkową; o wielkościach molowych cząstkowych będzie mowa w dalszej części wykładów). Ponieważ dla gazu doskonałego Vi id RT (sprawdzić !), wzór ten można napisać jako p RT dp RTd ln i Vi p Po scałkowaniu w granicach od 0 do p, otrzymuje się szukane wyrażenie na współczynnik lotności i lotność. fi RT dp Vi pxi 0 p p RT ln i RT ln Tak więc, aby obliczyć lotność, potrzebna jest zależność V = V(T,p,n1,n2,...,nk), czyli równanie stanu. Sześcienne równanie stanu ma postać p = p(T,V,n1,n2,...,nk). W takim przypadku współczynnik lotności należy liczyć całkując po objętości, używając do tego równoważnego wyrażenia w postaci V p pV RT dV RT ln m RT ln i n V RT i T ,V ,n ji Wzory te jednocześnie wskazują na pewną trudność przy obliczaniu lotności dla faz skondensowanych - cieczy i ciał stałych. W obu przypadkach musimy posiadać wiarygodne równanie stanu opisujące właściwości, począwszy od gazu (całkowanie rozpoczyna się od p = 0), co często jest nieosiągalne. 29 T. Hofman, © Wykłady z Termodynamiki, Wydział Chemiczny PW, kierunek: Biotechnologia, sem. letni 2015/2016 3. Roztwór doskonały i potencjał chemiczny wyrażony poprzez aktywności. Potencjał chemiczny gazu doskonałego (60.1) można przedstawić w nieco innej postaci. A mianowicie jako i T , p i0 T , p 0 RT ln p RT ln xi p 0 Wyrażenie w nawiasie kwadratowym jest potencjałem chemicznym czystego gazu doskonałego pod ciśnieniem p, czyli i°(T,p). Uwzględniając to, dochodzi się do równania, i T , p i0 T , p RT ln xi które stanowi podstawę fenomenologicznej definicji roztworu doskonałego. Roztwór doskonały to taki, w którym potencjały chemiczne wszystkich składników spełniają powyższy wzór. Oczywiście mieszanina gazów doskonałych tworzy roztwór doskonały. Ale znaczenie tego pojęcia daleko wybiega poza ten szczególny przypadek. Przedstawione wyrażenie na potencjał chemiczny można wyprowadzić z oddziaływań międzycząsteczkowych. Najczęściej spotykana interpretacja molekularna roztworu doskonałego mówi, że w roztworze tym wszystkie oddziaływania i właściwości cząsteczek są takie same. Oznacza to, że ściśle mówiąc, roztworem doskonałym będzie jedynie roztwór substancji A w A, ale wiele rzeczywistych mieszanin zawierających bardzo podobne składniki zachowuje się w sposób zbliżony do roztworu doskonałego. Na przykład mieszaniny izotopowe, mieszaniny zawierające składniki będące bliskimi elementami tego samego łańcucha homologicznego. Jakkolwiek przy spełnieniu tych warunków molekularnych uzyskuje się zawsze roztwór doskonały, to w rzeczywistości wymagania mogą być mniej restrykcyjne, zależą jednak od konkretnego modelu budowy roztworu. I tak na przykład w często stosowanym modelu siatkowym, w którym przyjmuje się quasi-krystaliczną strukturę cieczy, do doskonałości prowadzi spełnienie warunku, aby energia oddziaływania każdej pary (lub kontaktu) różnych cząsteczek, równała się średniej arytmetycznej energii oddziaływań pomiędzy takimi samymi cząsteczkami, czyli ij 1 ii jj 2 przy dodatkowym założeniu, że cząsteczki mają taki sam kształt. Przyjmując ten sam tok rozumowania co przy wprowadzaniu lotności, dla roztworów rzeczywistych zastępuje się ułamek molowy specjalną funkcją zwaną aktywnością (ai). i T , p i0 T , p RT ln ai przy czym ai = 1 dla stanu odniesienia, dla którego i T , p i0 T , p . Aktywność można również zdefiniować poprzez różniczkę zupełną w stałej temperaturze di)T = RTdlnai)T przy warunku brzegowym ai = 1 dla i(T,p) =i°(T,p). Wyróżnia się kilka skal aktywności różniących się stanem odniesienia, który przeciwnie niż w przypadku lotności, może być różnie określony. Stan odniesienia zwykle przyjmuje się poprzez definicję współczynników aktywności (i) czyli i ai xi Współczynniki aktywności muszą spełniać warunki brzegowe, które jednocześnie definiują stan odniesienia. Najczęściej stosuje się następujący stan odniesienia: Dla każdego składnika mieszaniny i = 1 dla xi = 1 wtedy stanami odniesienia są czyste składniki w warunkach (T,p) Definicję taką nazywa się symetrycznym układem odniesienia. Współczynniki aktywności są podstawową funkcją definiującą potencjał chemiczny dla składników roztworów ciekłych. Różne układy odniesienia wynikają w gruncie rzeczy z trudności w przewidywaniu wartości współczynników. Można to zrobić na podstawie modelu roztworu ciekłego, ale stopień złożoności budowy i oddziaływań fazy ciekłej jest na tyle wysoki, że otrzymuje się wyniki niezbyt dokładne, szczególnie dla mieszanin silnie niedoskonałych (tzn. dalekich od roztworu doskonałego). Dlatego też dąży się do sytuacji, w której poprzez właściwy dobór systemu odniesienia, uzyskuje się chociaż przedział stężeń, w którym jakiś 30 T. Hofman, © Wykłady z Termodynamiki, Wydział Chemiczny PW, kierunek: Biotechnologia, sem. letni 2015/2016 współczynnik aktywności jest na tyle bliski jedności, że może być pominięty. Tak jest dla przypadku nadmiaru składnika (w symetrycznym układzie odniesienia) i w stanie jego znacznego rozcieńczenia (dla niesymetrycznego układu odniesienia). 4. Zestawienie różnych form wyrażeń na potencjał chemiczny i(T,p) = stan odniesienia warunki brzegowe fi pi dla p 0 (i 1 dla p 0) lotność fi, współczynnik lotności i f i0id T , p 0 RT ln i0 p f i pii pxii czysty gaz doskonały (T, p°= 1 bar) współczynnik aktywności w niesymetrycznym układzie odniesienia i* i* T , p RT ln xi i* 0id i p T , p RT ln 0i p 0 i0 T , p RT ln xi i = 1 dla xi = 1 czysta substancja (T,p) stan substancji w rozcieńczeniu nieskończenie wielkim, ekstrapolowany do czystego składnika (T,p) 31 i* 1 dla xi 0 najczęściej stosuje się do 1. mieszaniny gazów gaz doskonały 1. roztwór doskonały współczynnik aktywności w symetrycznym układzie odniesienia i i0 T , p RT ln xi i przypadki szczególne 2. roztwory ciekłe subst. niepolarnych roztwory ciekłe i stałe 2. bardzo stężony rzeczywisty roztwór i i0 T , p RT ln xi bardzo rozcieńczony rzeczywisty roztwór i i* T , p RT ln xi 1. roztwory ciekłe lub stałe rozcieńczone 2. roztwory składników nie występujących w stanach skondensowanych