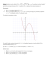Folie
Transkrypt
Folie
2010-04-08 Wykład II ELEKTROCHEMIA Wykład II b • • • Nadnapięcie Równanie Buttlera-Volmera Równania Tafela Równowaga dynamiczna i prąd wymiany Jeśli układ jest rozwarty i przez elektrolizer nie płynie prąd, to nie oznacza wcale, że na elektrodach nie zachodzą procesy. Równowaga na granicy faz elektroda roztwór ma charakter dynamiczny zatem na elektrodach nieustannie trwają procesy utleniania i redukcji. Zachodzą one w obu kierunkach z taką samą szybkością, a zatem związane z nimi prądy mają taką samą wielkość: i0 (|ired| = |iox|) i0 jest tzw. prądem wymiany i z reguły jest niemierzalny czyli bliski 0. Różnica potencjałów elektrod takiego otwartego ogniwa jest równa jego SEM i można ją obliczyć z równania Nernsta. Mówi się wtedy o potencjale równowagowym układu. 1 2010-04-08 POLARYZACJA ELEKTROLITYCZNA i nadpotencjał Elektroda spolaryzowana nie jest już układem w stanie równowagi i nie można jej potencjału opisac za pomocą równania Nernsta. Przebiegają na niej procesy nieodwracalne. Zmianę potencjału elektrody w stosunku do potencjału równowagowego nazywamy POLARYZACJĄ ELEKTROLITYCZNĄ. Miarą polaryzacji elektrolitycznej jest nadpotencjałem (η), definiowany jako różnica między potencjałem elektrody spolaryzowanej i potencjałem równowagowym . Nadpotencjał elektrolizera jest sumą nadpotęcjału katodowego i anodowego. η = E − Eeq Eeq - potencjał elektrody w stanie równowagi E - potencjał elektrody w warunkach przepływu przez nią prądu większego od prądu wymiany, tj. potencjał elektrody spolaryzowanej Er. reakcje anodowe: η > 0 reakcje katodowe: η < 0 nadpotencjał jest wprost proporcjonalny do gęstości prądu płynącego przez elektrodę Nadpotencjał w elektrolizie, czyli nadnapięcie rozkładowe Napiecie rozkładowe jest suma przeciwpotencjału elektromotorycznego (PEM) spadku omowego (iR) oraz nadnapięcia (η): U roz = PEM + η + iR Nadnapięcie procesu elektrolitycznego jest sumą nadnapięcie katodowego (ηk) i anodowego (ηa) z reguły elektrody nie są identyczne stąd ich nadnapięcia będą różne. Na obserwowaną wartość mierzonego nadnapięcia składają się takie wielkości jak: nadnapięcie oporowe (ηΩ), nadnapięcie pseudooporowe (η'Ω), nadnapięcie aktywacyjne (elektroaktywacyjne) (ηE), nadnapięcie stężeniowe (dyfuzyjne) (ηS). η = ηΩ + η'Ω +ηE + ηS Nadnapięcie oporowe i pseudooporowe nadnapięcie oporowe (ηΩ) jest związane z omowym spadkiem potencjału na powierzchni elektrody pracującej, wywołany małym przewodnictwem warstw przyelektrodowych roztworu. Czyli efektem wprowadzonym przez obecność PWE. nadnapięcie pseudooporowe (η'Ω) : występuje w przypadku stosowania układu trzyelektrodowego i jest związane z przepływem prądu przez elektrodę porównawczą. η = ηΩ + η' Ω + η E + ηS 2 2010-04-08 Nadnapięcie aktywacyjne i stężeniowe nadnapięcie aktywacyjne (elektroaktywacyjne) (ηE): jest to nadnapięcie procesu elektrodowego wywołane powolnym w porównaniu z innymi procesami elementarnymi przeniesieniem ładunku przez granicę faz elektroda elektrolit. nadnapięcie stężeniowe (dyfuzyjne) (ηS): stanowi sumę nadnapięcia dyfuzyjnego i reakcyjnego. Jest związane ze zmianami stężeń reagujących substancji w sąsiedztwie powierzchni elektrody. η = ηΩ + η' Ω +η E + ηS Nadnapięcie aktywacyjne – równanie Buttlera-Volmera (1) W warunkach równowagi przez granicę faz elektroda roztwór przepływają dwa znoszące się wzajem prądy cząstkowe, których wartość bezwzględna nazywa się prądem wymiany (i0) może zostać wyrażona zależnością: (1 − α)nF ( E r − E°) − αnF (E r − E°) i0 = nFkS cred exp = nFkScox exp RT RT gdzie: n – liczba elektronów bioracych udział w procesie elementarnym, F – stała Faradaya, ks - standardowa stała szybkości reakcji elektrodowej, w warunkach stanu równowagi procesu elektrodowego i równości stężeń formy utlenionej i zredukowanej, cred i cox –stężenia odpowiednio formy zredukowanej i utlenionej depolaryzatora α - współczynnik przeniesienia ładunku, tj.: ta część energii elektrycznej która zostaje zużyta na zmniejszenie energii swobodnej aktywacji procesu redukcji, Er – potencjał elektrody spolaryzowanej E° – potencjał standardowy (równowagowy elektrody). E r − E o = ηE szczegółowe wyprowadzenie, gdyby kogoś interesowało można znaleźć w literaturze Energia F(E-E°) Współczynnik przeniesienia ładunku (1-α)F(E-E°) αF(E-E°) η substrat produkt Postęp reakcji 3 2010-04-08 Równanie Buttlera-Volmera (2) stosunek stężeń w stanie równowag wyraża się wzorem nazywanym wykładniczą postacią równania Nernsta: cox nF(E r − E°) = exp cred RT Wyznaczając z tego równania wartość Er - E° i podstawiając do równania na prąd wymiany otrzymujemy zależność: α i0 = nF k S cred cox(1− α ) Wyznaczoną z tego równania wartość kS podstawiamy do wzoru z poprzedniego slajdu i otrzymujemy zależność opisującą prąd związany z reakcją elektrodową w funkcji nadnapięcia czyli równanie Butlera - Volmera. (1 − α)nFη − αnFη i = i0 exp − exp RT RT Równanie Buttlera-Volmera (3) rozwiązanie i i i0 i ox Er η i red i0 Równanie Buttlera-Volmera (4): wpływ współczynnika przeniesienia ładunku i η α ~ 0,75 α ~ 0,5 α ~ 0,25 4 2010-04-08 Równanie Buttlera-Volmera (5): Przybliżenie dla małych wartości nadnapiecia Dla niewielkich nadnapięć równanie Butlera - Volmera można uprościć korzystając przybliżenia funkcji ex otrzymujemy wówczas wyrażenie: (1 − α ) nFη α nFη i0 nFη i = i0 1 + − 1 − ⇒ RT RT RT W tym przybliżeniu mamy więc do czynienia z liniową zależnością prądu od nadnapięcia Równanie Buttlera-Volmera (6): Przybliżenie dla dużych wartości nadnapięcia – równania TAFELA Dla dużych nadnapięć równanie Butlera - Volmera przyjmuje dwie postaci graniczne zależne od tego, czy rozważamy proces utleniania (nadnapięcie dodatnie - ηa ), czy też redukcji (nadnapięcie ujemne ηk) (1 − α)nFηa ia = i0 exp RT − αnFηk ik = i0 exp RT Równania Tafela η = a ± b ln i ηk = RT RT ln i0 − ln ik αnF αnF ηa = log|i| RT RT ln i0 + ln ia (1 − α)nF (1 − α)nF α1 α1 log i0,1 α2 α2 log i0,2 α1 > α2 η 5