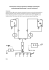Medyczne zastosowanie kriotechniki do przechowywania
Transkrypt
Medyczne zastosowanie kriotechniki do przechowywania
Techniki niskotemperaturowe w medycynie Medyczne zastosowanie kriotechniki do przechowywania preparatów biologicznych, w urządzeniach diagnostycznych i kriochirurgii. Wykonała: Patrycja Czonstke Inżynieria mechaniczno – medyczna II sem, st. II 28.11.2011r. 1. Leczenie „zimnem” Uważa się, że leczenie zimnem jest jedną z najstarszych form leczenia. Już 2500 lat p.n.e. Egipcjanie stwierdzili, że zimno działa uśmierzająco na miejscu urazu i ma działanie przeciwzapalne. Współczesne technologie pozwalają na uzyskiwanie dużo niższych temperatur niż ta, jaką zapewniał okład ze śniegu lub lodu. Wiadome jest nam, że „zimno” zmniejsza obrzęk oraz krwawienie, oraz nie wywołuje skutków ubocznych i nie obciąża układu krążenia [1]. Oczywiście, długie przebywanie na mrozie nie jest dla nas korzystne, i nie należy tej kwestii w żaden sposób łączyć z leczniczym działaniem „zimna”. 2. Kriogeniczne gazy w medycynie Określone przez lekarzy parametry zabiegów kriomedycznych (temperatura końcowa tkanki, czas zabiegu) wskazują na przydatność do zastosowań w urządzeniach kriomedycznych czynników roboczych o temperaturze wrzenia niższej od 200 K (-73`C) Powyższe kryterium spełniają wszystkie czynniki zestawione w tabeli 1. Hel, neon i ksenon są czynnikami dość drogimi, co niekorzystnie wpływa na ekonomiczność eksploatacji. Wodór oraz metan tworzą mieszaniny wybuchowe z powietrzem, natomiast ciekły tlen ma wysoką aktywność chemiczną. Kriociecze wykorzystywane w medycynie oprócz niskiej temp. Wrzenia, dużej wartości ciepła parowania i ciepła właściwego, nie mogą być aktywne chemicznie, trujące, wybuchowe a także powinny być łatwo dostępne i tanie. Tylko wyżej wspomniane trzy gazy spełniają wszystkie warunki i są wykorzystywane w krioterapii oraz kriochirurgii [2]. Tab. 1 Własności czynników kriogenicznych [2]. 3. Przechowywanie preparatów biologicznych Ciekły azot oraz suchy lód są idealnymi środkami chłodzącymi podczas transportu i czasowego przechowywania preparatów biologicznych takich, jak: krew, tkanka lub narząd. Zestalony dwutlenek węgla zapewnia nieprzerwane przez określony czas utrzymywanie temperatury w przedziale od +10°C do -25°C. Poza zdolnościami chłodniczymi CO2 posiada właściwości bakteriostatyczne. Granulat suchego lodu jest dostarczany w specjalnych kontenerach. Dzięki swoistej izolacji pojemników suchy lód można w nich przechowywać przez wiele dni bez strat i zmian jego właściwości. Przykładowy pojemnik z suchym lodem przedstawia rys. 1 [5]. Czysty azot wrze w temperaturze -195,8 °C (77,35 K) w zależności od czystości i aktualnego ciśnienia atmosferycznego w zakresie 77–78 K, a ulega zestaleniu przy -210,0 °C (63,14 K). Na rynku wielu producentów oferuje pojemniki do przechowywania preparatów biologicznych, przykładowy znajduje się na rys. 2. Temperatura przechowywania może sięgać nawet –190°C [5]. Rys. 1 Pojemnik izotermiczny z suchym lodem [5] Rys. 2 Pojemnik z ciekłym azotem [5]. 4. Przechowywanie narządów Przechowywanie narządów są opisane w normach i stosownych rozporządzeniach. Aby narząd nadawał się do przeszczepienia należy wytyczne te, ściśle przestrzegać. Przechowywanie narządów rozpoczyna się od odpowiedniego schłodzenia narządu, a kończy się utrzymaniem stałej temperatury w odpowiednim pojemniku lub komorze chłodniczej. Wyróżniamy dwie metody chłodzenia narządów w zależności od ich rodzaju, a są to [4]: • metoda termostabilna – jest to metoda polegająca na zanurzeniu narządu w płynie o temperaturze pomiędzy 0 a 4oC. Technika ta jest najbardziej rozpowszechniona. Jest prosta, mało kosztowna i skuteczna w odniesieniu do takich narządów, jak wątroba czy trzustka oraz narządów takich jak: palce, język czy uszy. Pobrany narząd zanurzony w płynie perfuzyjnym o funkcjach konserwujących jest w sposób sterylny i hermetyczny umieszczony w naczyniu. Naczynie to zabezpieczone podwójnym opakowaniem sterylnych worków plastikowych jest z kolei umieszczane w izotermicznym kontenerze lub pojemniku. W latach 90 pojemniki takie na czas przechowywania i transportu wypełnione były lodem w kostkach. Aktualnie najczęściej stosowanym rozwiązaniem jest wykorzystanie suchego lodu. Stosowane są także droższe, zapewniające większe bezpieczeństwo pojemniki wyposażone w układy sprężarkowe lub termoelektryczne. Długość okresu przechowywania i transportu narządów w przypadku tej metody nie może przekroczyć 48 godzin. • Metoda ciągłej perfuzji hipotermicznej - łączny okres przechowywania i transportu jest równy 72 godzinom. W przypadku tej metody narząd umieszczany jest w sterylnym naczyniu, gdzie jest stale perfundowany pulsacyjnie roztworem chłodzącym wzbogaconym w tlen, gdzie można stale kontrolować temperaturę, ciśnienie perfuzyjne oraz parametry biochemiczne przy użyciu układów elektronicznych czujników połączonych z komputerem przetwarzającym te informacje. W zależności od tego z jakim narządem mamy do czynienia, wyróżniamy trzy rodzaje pojemników izotermicznych, a mianowicie [4]: • pojemniki izotermiczno-elektroniczne – są to pojemniki przeznaczone głównie do transportu nerek czy serc, czyli narządów, które w trakcie transportu wymagają stałej kontroli parametrów dokonywanej przez zespół czujników i analizowanych przez komputer. Urządzenia tego typu (rys. 3) są w związku z tym urządzeniami najdroższymi na rynku i ich używanie do transportu innych organów jest nieopłacalne ze względów finansowych. Pojemniki tego typu posiadają układ regulacji temperatury z dokładnością nawet do 0,01 K oraz możliwość zmiany takich parametrów, jak ciśnienie perfuzyjne, gęstość płynu konserwującego, czy inne parametry biochemiczne; • pojemniki izotermiczne do transportu narządów typu A – są to pojemniki do transportu narządów, takich jak wątroba i trzustka. Urządzenia tego typu (rys. 4) nie posiadają zwykle układu regulacji temperatury, a jedynie zapewniają temperaturę na wybranym poziomie (przeważnie 0-4oC). Jako sposób chłodzenia dla utrzymania niskiej temperatury w przestrzeni ładunkowej, w pojemnikach tego typu wykorzystuje się zazwyczaj suchy lód oraz rzadziej urządzenie sprężarkowe; • pojemniki izotermiczne do transportu narządów typu B – są to pojemniki (rys. 5) przeznaczone do transportu narządów, które wymagają przyszycia lub przeszczepienia powrotnego. Do tego typu narządów należą amputowane w trakcie wypadków takie, jak: palce, języki, czy też np. małżowina uszna. Warunki temperaturowe wymagane przez narządy tego typu sprawiają, iż urządzenia takie działają przeważnie w zakresach od -10 do 5oC. Są to urządzenia uniwersalne posiadające możliwość regulacji temperatury przeważnie z dokładnością do 1 K, w zależności od rodzaju i wymagań narządu umieszczonego w środku. Rys.3 pojemnik izotermiczno – elektroniczny [4] Rys.4 Pojemnik typu A [4]. Rys. 5 Pojemnik typu B [4]. 5. Kriotechnika w urządzeniach diagnostycznych Przebieg leczenia zależy od prawidłowego rozpoznania choroby. Diagnostyka, czyli nauka o rozpoznawaniu chorób na podstawie wywiadu lekarskiego, analizy objawów i wyniku badań dodatkowych stanowi pierwszy i podstawowy etap procesu leczenia. Jedną z najnowszych metod, w których zastosowano technikę niskich temperatur, jest metoda wykorzystująca rezonans magnetyczny. Zjawisko rezonansu magnetycznego polega na wykrywaniu protonów (jąder wodoru) w badanym narządzie. Silne pole elektromagnetyczne, wytwarzane przez magnes nadprzewodzący pobudza protony do wysyłania promieniowania elektromagnetycznego. Co ważne, aby magnes stał się nadprzewodnikiem musi zostać schłodzony do temperatury około -270 oC. Takie chłodzenie zapewnia ciekły hel. Tomograf NMR wraz ze zbiornikiem z ciekłym helem znajduje się na rys. 6 [1, 5]. W niskich temperaturach spada opór elektryczny, co umożliwia uzyskanie przez magnesy nadprzewodzące pola magnetyczne o dużym natężeniu. Ponadto, stosunek sygnału użytecznego do szumów decyduje o jakości obrazowania i jest zależny liniowo od natężenia pola magnetycznego. Dlatego, im większe natężenie pola tym dokładniej można zmierzyć sygnał NMR, a tym samym tym lepszej jakości obraz można uzyskać. Od początku lat 80tych w tomografach MRI stosuje się magnesy z materiałów nadprzewodzących II typu. Jednym z najczęściej stosowanych w MRI nadprzewodników jest spiek niobu i tytanu [1]. Rys. 6 Tomograf NMR wraz ze zbiornikiem ciekłego helu [5]. 6. Kriochirurgia . Kriochirurgia polega na miejscowym, kontrolowanym niszczeniu zainfekowanych komórek poprzez działanie na nie temperaturami kriogenicznymi. Istotą działania kriochirurgii na tkankę jest przejście wody komórkowej i pozakomórkowej ze stanu ciekłego w stan stały. Aby zamrozić żywą tkankę temperatura tkanek musi być obniżona do -20° C. Ważną rolę odgrywa rodzaj komórek, bowiem istnieje znaczna różnica między wrażliwością różnych tkanek na niską temperaturę. Szczególnie wrażliwe są melanocyty, a tkanka łączna wykazuje znaczną oporność. Skuteczność destrukcji zależy także od szybkości zamrożenia i rozmrażania tkanki. Po zamrożeniu i rozmrożeniu cytoplazmy komórki zahamowany jest jej metabolizm. W konsekwencji dochodzi do oddzielenia tkanki wymrożonej, głównie zmienionej chorobowo, od tkanki zdrowej. Podstawowym celem kriochirurgii jest zamrożenie takiej objętości tkanki, jaka musiałaby być wycięta podczas tradycyjnego wycięcia chirurgicznego[2, 6]. Wyróżniamy trzy metody zamrażania tkanek [2]: 1) Metoda wykorzystująca bezpośrednie odparowanie czynnika – polega ona na zamrażaniu przy pomocy wacików nawiniętych na drewniane pałeczki (rys. 7), zanurzanych w ciekłym azocie. Dzięki swej porowatości wacik staje się "zbiorniczkiem" czynnika. Zetknięcie go ze skórą powoduje gwałtowne odparowanie azotu pod wpływem ciepła odbieranego od tkanki. Jest często stosowanym zabiegiem, głównie w zmianach łagodnych i płytkich. 2) Metoda natryskowa – urządzenia kriochirurgiczne wyposażone są w odpowiednie końcówki do zamrażania natryskiem (rys. 8). Natrysku dokonuje się zwykle z odległości około 1 cm od powierzchni skóry. Zabieg metodą natryskową polega na aplikowaniu ciekłego czynnika bezpośrednio na powierzchnię tkanki. Rozpylona ciecz kriogeniczna odparowuje, obniżając temperaturę powierzchni skóry. Do jej zastosowania niezbędne jest wytworzenie ciśnienia w zbiorniku, z którego podawany jest kriogen. 3) Metoda kontaktowa – zastosowanie krioaplikantów zamkniętych pozwala na leczenie zamian punktowych do średnicy kilku centymetrów. Zabieg metodą kontaktową wymaga zastosowania zamkniętego aplikatora (rys.9). W jego przestrzeni przepływa ciekły czynnik, który odbierając ciepło odparowuje. Do tkanki przylega powierzchnia mrożąca przekazująca ciepło od tkanki do kriogenu. Zastosowanie aplikatora zamkniętego uniemożliwia bezpośredni kontakt kriocieczy z powierzchnią skóry. Rys. 7 Metoda kontaktowa [2] Rys. 8 Metoda natryskowa [2]. Rys. 9 Metoda kontaktowa [2]. Zabiegi kriochirurgiczne cieszą się coraz większą popularnością, gdyż odznaczają się wieloma zaletami, m.in.[6]: • skutecznością; • krótkim czasem gojenia; • brakiem skutków ubocznych; • brakiem powikłań; • brakiem lub niewielkimi bliznami pozostającymi po zabiegu; • oddziaływaniem tylko na tkankę chorobowo zmienioną (w przypadku nowotworu: środki farmakologiczne- chemioterapia, inne formy leczenia - radioterapia oddziaływują na cały organizm); • prostą techniką zabiegu; • stosunkowo krótkim czasem zabiegu; • stosunkowo niskim kosztem zabiegu; • możliwością stosowania w warunkach ambulatoryjnych bez obecności anestezjologa (bez konieczności znieczulenia ogólnego, a znieczulenie miejscowe w wybranych przypadkach). W ostatnich latach kriochirurgia znalazła zastosowanie w różnych dziedzinach medycyny, a coraz większe ma także dla dermatologii. Poza nowotworami skóry ma zastosowanie w leczeniu nienowotworowych schorzeń skóry takich jak [6]: • brodawki zwykłe zwane potocznie kurzajkami; • włókniaki; • naczyniaki; • brodawki łojotokowe tzw. starcze; • stany przednowotworowe (rogowacenie posłoneczne i inne), • niektóre raki skóry; • kłykciny kończyste w obrębie narządów płciowych i odbytu; • odciski; • tatuaże; • trądziki; • łysienie plackowate; • i wiele innych. Dostępne urządzenia stwarzają możliwość wyboru w zależności od planowanego zakresu leczenia, częstotliwości wykorzystania urządzeń, jak i doświadczenia w przeprowadzaniu zabiegów. Najbardziej popularne w tej grupie są małe przenośne aparaty o pojemności do 1 dm3, w których ręczny nacisk na dźwignię zaworu umożliwia wypływ ciekłego azotu. Zaletą tych urządzeń jest możliwość wykonania zabiegu również u chorego w domu, a także mniejsze zużycie ciekłego azotu. Schemat takiego aparatu przedstawia rys. 10 [3]. Mimo, że zbiornik urządzenia jest izolowany, z otoczenia dopływa strumień ciepła. Powoduje on odparowywanie ciekłego azotu a w konsekwencji podnoszenie się ciśnienia. W celu zabezpieczenia przed nadmiernym wzrostem ciśnienia montuje się zawór bezpieczeństwa. W przypadku, gdy ciśnienie przekroczy wartość graniczną zawór otwiera się umożliwiając wydostanie się nadmiaru par ze zbiornika. Rys. 10 Schemat aparatu z ciekłym azotem [3]. Zamknięcie zaworu spustowego oraz rozpoczęcie pracy zaworu dozującego powoduje obniżenie ciśnienia w zbiorniku. Pod wpływem różnicy ciśnień między wnętrzem aparatu i otoczeniem następuje wypływ ciekłego czynnika. Proces wymiany ciepła odbywa się przez odparowywanie na powierzchni tkanki ciekłego czynnika kriogenicznego [3]. Nieco prostsza jest zasada działania aparatu z podtlenkiem azotu. Aparat ten, pobiera z butli pary podtlenku azotu i poddaje je procesowi dławienia izentalpowego. Proces ten powoduje powstanie mieszaniny parowo – cieczowej, którą natryskuje się na powierzchnię tkanki. Schemat aparatu z podtlenkiem azotu przedstawia rys. 11 [3]. Rys. 11 Schemat aparatu z podtlenkiem azotu [3]. 7. Bibliografia [1] Janowski T.; Technologie nadprzewodnikowe i plazmowe w energetyce; Lubelskie Towarzystwo Naukowe; Lublin 2009 [2] Chorowski M., Piotrowska A.: Ocena efektywności zabiegów kriochirurgicznych z wykorzystaniem ciekłego azotu i podtlenku azotu. Technika Chłodnicza i Klimatyzacyjna, nr 11/2004, część 1 [3] Chorowski M., Piotrowska A.: Ocena efektywności zabiegów kriochirurgicznych z wykorzystaniem ciekłego azotu i podtlenku azotu. Technika Chłodnicza i Klimatyzacyjna, nr 12/2004, część 2 [4] Przechowywanie i transport narządów ludzkich przeznaczonych do przeszczepu. Technika Chłodnicza i Klimatyzacyjna, nr 5/2007 [5] www.wentylacja.com [6] www.poradnikmedyczny.pl