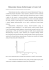Miareczkowanie Potencjometryczne
Transkrypt
Miareczkowanie Potencjometryczne
Instytut Ochrony Środowiska Państwowa Wyższa Szkoła Zawodowa im. H. Cegielskiego w Gnieźnie ĆWICZENIE 13 ANALIZA INSTRUMENTALNA Miareczkowanie Potencjometryczne Oznaczanie kwasu ortofosforowego w Coca-Coli za pomocą miareczkowania potencjometrycznego roztworem wodorotlenku sodu DZIAŁ: Potencjometria ZAGADNIENIA SEM; aparatura potencjometryczna; elektrody I-szego; II-go; III-go rodzaju; elektrody utleniającoredukujące; elektrody wskaźnikowe; elektrody porównawcze; ogniwo elektrochemiczne; klucz elektrolityczny; na czym polega miareczkowanie potencjometryczne metodą klasyczną, krzywa miareczkowania kw. ortofosforowego, dysocjacja kwasów wieloprotonowych, metoda pierwszej pochodnej, metoda drugiej pochodnej, LITERATURA: 1. 2. A. Cygański - "Metody elektroanalityczne", WNT, Warszawa, dowolny rok wydania. W. Szczepaniak "Metody instrumentalne w analizie chemicznej", PWN, Warszawa, dowolny rok wydania. 3. D. Kealey, P.J. Haines, tłum. ang. M. Galus – Krótkie wykłady – Chemia Analityczna; PWN W-wa 2005 I. WSTĘP I CEL ĆWICZENIA MIARECZKOWANIE POTENCJOMETRYCZNE polega na mierzeniu różnicy potencjałów między elektrodą wskaźnikową i elektrodą porównawczą po dodaniu każdej porcji odczynnika miareczkującego. Jest ono możliwe do wykonania wówczas, gdy dobierze się elektrodę wskaźnikową, która będzie reagowała na zmiany stężenia składnika oznaczanego lub odczynika miareczkującego, zachodzące podczas miareczkowania. Dodawanie odczynnika miareczkującego powoduje zmiany stężenia składnika oznaczanego. Początkowo względnie zmiany stężenia oznaczanych jonów są niewielkie i zmiany potencjału również są niewielkie. Natomiast w pobliżu punktu równoważności następuje skok potencjału. Ćwiczenia laboratoryjne z chemii analitycznej i instrumentalnej; oprac.; prowadzący: dr Agnieszka Matłoka Strona 1 Instytut Ochrony Środowiska Państwowa Wyższa Szkoła Zawodowa im. H. Cegielskiego w Gnieźnie Krzywe miareczkowania, przedstawiające zależność potencjału od objętości titranta, jest analogiczne do krzywej miareczkowania w alkacymetrii, redoksymetrii i kompleksometrii. Miareczkowanie potencjometryczne ma zastosowanie do oznaczania związków, jonów występujących w roztworach zabarwionych, mętnych lub do oznaczania kilku składników obok siebie w jednym miareczkowaniu. W przypadku miareczkowania kwasów wieloprotonowych np. kwasu ortofosforowego (trójprotonowy) wystąpią na krzywej miareczkowania dwa skoki. Krzywa miareczkowania potencjometrycznego dla oznaczania kwasu ortofosforowego za pomocą wodorotlenku sodu (lub wodorotlenku potasu) wykazuje charakterystyczny przebieg krzywej, co przedstawiono na – Ryc.1. pH = 9,6 pH = 4,5 KOH Ryc.1. Krzywa miareczkowania kwasu ortofosforowego za pomocą wodorotlenku potasu. [źródło:A.Cygański, Chemiczne metody analizy ilościowej, WNT W-wa (1999)] Ćwiczenia laboratoryjne z chemii analitycznej i instrumentalnej; oprac.; prowadzący: dr Agnieszka Matłoka Strona 2 Instytut Ochrony Środowiska Państwowa Wyższa Szkoła Zawodowa im. H. Cegielskiego w Gnieźnie Na podstawie przeprowadzonego doświadczenia, gdy chcemy obliczyć zawartość kwasu ortofosforowego zapisujemy równania reakcji następująco: H3PO4 + KOH ⇌ KH2PO4 + H2O KH2PO4 + KOH ⇌ K2HPO4 + H2O Następnie dodajemy stronami: H3PO4 + KOH+ KH2PO4 + KOH⇌ KH2PO4 +H2O+K2HPO4+ H2O H3PO4 + 2KOH+ KH2PO4 ⇌ KH2PO4 +2H2O+K2HPO4 H3PO4 + 2KOH ⇌ 2H2O+K2HPO4 PRZYKŁAD: Szczegółowy maksymalny poziom fosforanów dodatków do żywności: E 1410Fosforan monoskrobiowy quantum satis E 1412 Fosforan diskrobiowy quantum satis E 1413 Fosforanowany fosforan diskrobiowy quantum satis E 338–452 kwas fosforowy – fosforany – di-, tri- i polifosforany 3 000 (mg/l lub mg/kg) do ko polewy (syropy do naleśników, aromatyzowane syropy do koktajli mlecznych i lodów spożywczych; produkty podobne). II(Akty o charakterze nie ustawodawczym) ROZPORZĄDZENIA KOMISJI (UE) NR 1129/2011 z dnia 11 listopada 2011 r. mieniające załącznik II do rozporządzenia Parlamentu Europejskiego i Rady (WE) nr 1333/2008 poprzez ustanowienie unijnego wykazu dodatków do żywności; Tekst mający znaczenie dla EOG Celem eksperymentu jest przeprowadzenie analizy miareczkowania potencjometrycznego, aby oznaczyć zawartość ortofosforanów w napoju spożywczym Coca-Cola. W doświadczeniu jako titrant wykorzystuje się roztwór wodorotlenku sodu, uzyskane wyniki należy porównać z Ćwiczenia laboratoryjne z chemii analitycznej i instrumentalnej; oprac.; prowadzący: dr Agnieszka Matłoka Strona 3 Instytut Ochrony Środowiska Państwowa Wyższa Szkoła Zawodowa im. H. Cegielskiego w Gnieźnie dopuszczalnymi normami określającymi zawartości tego związku w porównać z danymi na etykiecie. tym napoju lub II. SPRZĘT I ODCZYNNIKI: - pH-metr wyposażony w elektrodę EPP-3t, EPP-3, - pipety jednomiarowe i wielomiarowe poj. 10 ml 1szt. - mieszadło magnetyczne typ ES 21H (Wigo), - dipol, - zlewki poj. 100ml 2szt; - zlewki poj.200ml 2szt. - zlewka 50 ml 1 szt. - mianowany r. NaOH 0,1M, - biureta poj.25ml (50 ml) ze statywem - wzorcowy roztwór buforowy pH 7.00 - Coca-Cola (odpowiednio przygotowana do analizy) III. METODYKA: 1. Włączyć pH-metr i ustawić rodzaj pracy na pomiar pH. Elektrody umieścić w uchwycie statywu i podłączyć przewody do gniazda w tylnej ściance obudowy pH-metru. 2. Skalibrować pH-metr stosując bufor wzorcowy. 3. Odpipetować 30 ml pozbawionej dwutlenku węgla Coca-Coli (wygotowanej i ochłodzonej) do zlewki o poj. 50 ml, umieścić w statywie z elektrodami i mieszadłem. 4. Po uruchomieniu mieszadła dodawać mianowany roztwór wodorotlenku sodu porcjami po 0,2 ml, notując każdorazowo wskazania pH-metru. Miareczkowanie przerwać w momencie, gdy po drugim skoku wartości pH kolejne porcje odczynnika dają tylko niewielkie i równe przyrosty pH. ZESTAWIENIE WYNIKÓW: Objętość dodanego titrantu V NaOH [ml] 0 0,2 0,4 0,6 …… itd. …… itd. pH Kolejne przyrosty wartości ΔpH Kolejne przyrosty ΔV [ml] Pierwsza pochodna ΔpH/Δv Druga pochodna Δ2pH/Δv2 Ćwiczenia laboratoryjne z chemii analitycznej i instrumentalnej; oprac.; prowadzący: dr Agnieszka Matłoka Strona 4 Instytut Ochrony Środowiska Państwowa Wyższa Szkoła Zawodowa im. H. Cegielskiego w Gnieźnie OPRACOWANIE WYNIKÓW: 1. Wykreślić na papierze milimetrowym wykresy zależności : a) Metoda graficzna pH = f(Vtitrantu) b) Metoda pierwszej pochodnej ΔpH/Δv = f(Vtitrantu) c) metoda drugiej pochodnej Δ2pH/Δv2 = f(Vtitrantu) 2. Wskazać punkty końcowe miareczkowania miareczkowania pH = f(Vtitrantu) VPK1 i VPK2. odczytane z krzywej 3.Zapisać równanie reakcji na całkowite oznaczenie zawartości ortofosforanów w reakcji z wodorotlenkiem sodu na podstawie przeprowadzonego doświadczenia miareczkowania potencjometrycznego 4.Obliczyć zawartość kwasu ortofosforowego w Coca-Coli na podstawie wyników z przeprowadzonego doświadczenia; obliczenia proporcjami. IV. WNIOSKI Sformułować wnioski na podstawie wyników z przeprowadzonego doświadczenia i porównać z dopuszczalnymi normami zawartości ortofosforanów napojach spożywczych na podstawie źródeł zawartych w literaturze oraz dopuszczalnych zawartości fosforanów w wodach powierzchniowych i ściekach. Ćwiczenia laboratoryjne z chemii analitycznej i instrumentalnej; oprac.; prowadzący: dr Agnieszka Matłoka Strona 5