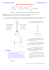kwas 3-nitroftalowy - Instytut Chemii Organicznej
Transkrypt
kwas 3-nitroftalowy - Instytut Chemii Organicznej
KWAS 3-NITROFTALOWY O O + H2SO4 stęż. O M.cz. 148,1 COOH COOH HNO3 dym., COOH O2N COOH NO2 211,1 211,1 Substraty: Bezwodnik ftalowy 14,8 g (0,1 mola) Kwas azotowy dymiący 6,2 ml Kwas azotowy stęż. 27 ml Kwas siarkowy stęż. 19,5 ml Reakcję należy prowadzi pod wyciągiem! W kolbie trójszyjnej pojemności 250 ml zaopatrzonej w mieszadło mechaniczne, termometr i nasadkę dwuramienną z chłodnicą zwrotną umieszcza się 14,8 g bezwodnika ftalowego (uwaga 1) i 15 ml stężonego kwasu siarkowego. Zawartość kolby ogrzewa się mieszając na łaźni wodnej lub elektrycznej, aż temperatura osiągnie 80° i nastąpi całkowite rozpuszczenie bezwodnika. Usuwa się wówczas łaźnię i powoli dodaje z wkraplacza mieszaninę 6,2 ml dymiącego kwasu azotowego* i 4,5 ml stężonego kwasu siarkowego (uwaga 2). Szybkość wkraplania ustala się taką, aby masę reagującą utrzymywać w temperaturze 100-110°. Następnie wkrapla się 27 ml stężonego kwasu azotowego z taką szybkością, aby temperatura nie przekroczyła 110°. Po wkropleniu mieszając ogrzewa się zawartość kolby, utrzymując temperaturę 100-110° przez 2 godziny i pozostawia na noc w temperaturze pokojowej. Mieszaninę wylewa się do 50 ml wody, chłodzi i sączy przez lejek z pianką. Osad kwasów 3-i 4-nitroftalowych miesza się następnie z 6 ml wody w celu rozpuszczenia większości kwasu 4-nitroftalowego. Po ponownym odsączeniu osadu pod zmniejszonym ciśnieniem, krystalizuje się go Opracowano na podstawie skryptu autorstwa Stefana Zawadzkiego i Karola Kociołka pt. "Laboratorium z chemii organicznej" wydanego w Łodzi w roku 2004 nakładem Politechniki Łódzkiej. z 6-9 ml wrzącej wody. Odsączony produkt suszy się na bibule. Wydajność surowego kwasu 3-nitroftalowego o tt. 208-210° (zatopiona kapilara) wynosi 6,5 g. Po ponownej krystalizacji z 15 ml wody otrzymuje się około 5,3 g (25%) czystego kwasu 3-nitroftalowego o tt. 216-218° (zatopiona kapilara). Kwas 4-nitroftalowy, który można wyodrębnić z pozostałych roztworów wodnych ma tt. 163-166°. * Kwas azotowy dymiący (d=1,5g/cm3, około 95%) otrzymuje się w wyniku destylacji mieszaniny równych objętości stężonego kwasu azotowego i stężonego kwasu siarkowego. Zbiera się taką ilość destylatu, aby stanowiła ona nieco mniej niż połowę objętości stężonego kwasu azotowego użytego do destylacji. Uwaga l. Pył bezwodnika ftalowego drażni błony śluzowe. Uwaga 2.. Stężony kwas siarkowy i dymiący kwas azotowy są cieczami silnie żrącymi. Powodują silne, bolesne oparzenia. Ponadto dymiący kwas azotowy wydziela toksyczne tlenki azotu. Literatura: • • Arendt A., Kołodziejczyk A.M., Sokołowska T.: Ćwiczenia Laboratoryjne z Chemii Organicznej. Wydawnictwo Politechniki Gdańskiej, Gdańsk 1980, str. 68; Vogel A.J.: Preparatyka Organiczna. Wyd. II, WNT, Warszawa 1984, str. 717; Opracowano na podstawie skryptu autorstwa Stefana Zawadzkiego i Karola Kociołka pt. "Laboratorium z chemii organicznej" wydanego w Łodzi w roku 2004 nakładem Politechniki Łódzkiej.