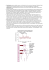U = V
Transkrypt
U = V
TERMODYNAMIKA
Nauka o cieple i procesach cieplnych
Bada zjawiska cieplne i procesy mające
charakter przemian energetycznych
Dwa podejścia:
- termodynamika klasyczna - doświadczalna
(fenomenologiczna)
- termodynamika statystyczna - teoretyczna
TERMODYNAMIKA KLASYCZNA
Bada procesy cieplne z makroskopowego punktu widzenia
Wielkości charakterystyczne:
- T – temperatura
-K
- p – ciśnienie
- Pa
- V – objętość
- m3
- n – ilość substancji
- mol
- S – entropia
- J/K
- Q – ciepło
- W – praca
- – sprawność
-J
-J
--
TEMPERATURA
Wielkość fizyczna będąca miarą „ogrzania” ciała
- parametr stanu
Pomiar temperatury wymaga zastosowania
1) ciała termometrycznego – substancji której właściwości
zależą od temperatury:
- długość
- ciśnienie
- opór
- kolor
- kształt
2) skali temperatury
SKALE TEMPERATUR
-1592–1603 pierwszy termoskop cieczowy - Galileusz
przyrząd do oceny temperatury, nie mający
wyskalowanej podziałki
-skala Fahrenheita 1724
0° temperaturę mieszaniny lodu, wody i salmiaku (NH4Cl),
32° krzepnięcie wody,
96° temperaturę ciała zdrowego człowieka,
212° temperatura wrzenia wody.
-skala Celsjusza 1742
0° wrzenie wody,
100 ° krzepnięcie wody.
1850 M. Strömer odwrócił te wartości
-skala Kelwina 1848 (W. Thomson (lord Kelvin))
- 273,16 – temperatura punktu potrójnego wody
- 1/273,16 – kelwin (K)
- 0 – temperatura zera absolutnego
- w określeniu innych temperatur pomocnicze są
temperatury wzorcowe
PUNKTY STAŁE DEFINICYJNE MST–90
Rodzaj
substancji
3He
Rodzaj
punktu
V
MST–90
{T90}K
{t90}C
3–5b
–270,15
–268,15
e–H2
T
13,8033
–259,3467
e–H2 (lub He)
V
(lub
użycie G)
17c
–256,15
e–H2 (lub He)
V
(lub
użycie G)
20,3C
–252,85
Ne
T
24,5561
–248,5939
02
T
54,3584
–218,7916
Ar
T
83,8058
–189,3442
Hg
T
234,3156
–38,8344
H2O
T
273,16
0,01
Ga
F
302,9146
29,7646
In
C
429,7485
156,5985
Sn
C
505,078
231,928
692,677
419,527
Zn
C
Al
C
933,473
660,323
Ag
C
1234,93
961,78
Au
C
1337,33
1064,18
Cu
C
1357,77
1084,62
a Mieszanina orto- i parawodoru w równowadze;
b dowolna temperatura z tego zakresu;
c punkt stosowany przy wzorcowaniu
platynowego termometru oporowego;
V — ciśnienie pary nasyconej 3He lub 4He;
T — punkt potrójny;
G — termometr gazowy helowy;
Wx — wrzenie pod ciśn. 33 330,6 Pa;
W — wrzenie,
R — punkt rosy,
F — topnienie,
C — krzepnięcie
(wszystkie pod ciśn. 101 325 Pa)
SPOSOBY MIERZENIA TEMPERATURY
1) Termometr gazowy: 12000 K
R
skala
- stałej objętości
punkt
potrójny
wody
para
wodna
woda
lód
gaz
rtęć
R
p0 611,2 Pa 4,58 mmHg
B
p
T
p
T T0
p0 T0
p0
T T0
ruchome
ramię
A
T0 273,16 K 0,01 C
pV0 nRT
gDx
gDx0
próżnia
D x0
- stałego ciśnienia
p0V0 nRT0
B
Dx
A
gaz
ciecz
Dx
o
T T0
temperaturze
Dx0
T
zależność objętości i ciśnienia gazu od temperatury
2) Termometry dylatacyjne:
- cieczowe 70÷1000 K
pentan:
70÷300 K
spirytus: 200÷350 K
rtęć: 240÷700 K
- ciał stałych
skala
kapilara
zbiornik
wypełniony cieczą
3) Termometry odkształceniowe bimetalowe
rozszerzalność temperaturowa cieczy i ciał stałych
4) Termometry oporowe
– metalowe: 0,5÷1800 K
platynowe, miedziane
TR
R
R
– termistorowe: 200÷1300 K
TiO2 i MgO; Ge + domieszki; MgAl2O4
T R (R )
zależność oporu elektrycznego od temperatury
T
T
5) Termopary – ogniwa termoelektryczne
metal B
V
Bi–Cu
Fe–Cu
Fe–Ag
Pt–PtRh
Cu–konstantan
U = V1 – V0
T1
V1
V0
T0
metal A
zjawisko termoelektryczne - powstawanie kontaktowej różnicy
potencjałów na złączu 2 różnych metali
6) Termometria magnetyczna: 10-6÷1 K
Cu; Pt
zmiany podatności magnetycznej idealnego paramagnetyka:
1
~
T
7) Metody optyczno-gazowe: poniżej 0,001 K
prędkość cząsteczek gazu zależy od temperatury – obszar
wypełniony gazem rozszerza się tym szybciej, im jest gorętszy
8) Termokolory: 200÷1000 K
nieorganiczne substancje termochromowe; ciekłe kryształy
zmiany barwy przy przemianach fazowych
9) Pirometry: 200÷ +10000 K
a) optyczne: 600÷10000 K
jasność ciała porównywana jest z jasnością wzorca
- żarzonym włóknem o określonej temperaturze
b) całkowitego promieniowania 200÷tys. K
mierzona jest ilość energii docierającej
od świecącego ciała
całkowite natężenie promieniowania zależy od temperatury ciała
prawo Stefana-Boltzmana
a) wielobarwne: 200÷tys. K
badane jest natężenie światła dla kilku długości fal
rozkład widmowy emitowanego światła zależy od temperatury
prawo Plancka
PROMIENIOWANIE CIAŁA
DOSKONALE CZARNEGO
T1
T2
T3
T1 T2 T3
9) Topniki: 600÷3000 K
a) wskaźniki pirometryczne: topnienie substancji
b) stożki Segera (stożki pirometryczne): mięknięcie substancji
topnienie substancji
CIŚNIENIE
SPOSOBY MIERZENIA CIŚNIENIA
1) Barometr rtęciowy zamknięty
2) Barometr rtęciowy otwarty
3) Aneroid
4) Hipsometr
5) Próżniomierz kompensacyjny
6) Próżniomierz jonizacyjny
DOŚWIADCZENIE TORRICELLIEGO
1643
rtęć
rtęć
760 mmHg
800 mm
próżnia
ciśnienie
słupa rtęci
ciśnienie
atmosferyczne
p=760 mmHg =1013hPa
PRAWA GAZÓW DOSKONAŁYCH
1) Boyle’a–Mariotte’a 1662-1676
p
p0
V
V0
T const
p
pV p0V0
pV const
przemiana izotermiczna
V
2) Charlesa 1789
p
p0
V0
V0
V const
p
p
const
T
T
p p0
T T0
przemiana izochoryczna
3) Gay-Lussaca 1802
p0
p0
V
V0
p const
V
V
const
T
T
V V0
T T0
przemiana izobaryczna
4) Clapeyrona 1834
pV nRT
- n – liczba moli gazu
- R=8,31447 J/(mol·K) – stała gazowa
5) Van der Waalsa 1873
2
p an V nb nRT
2
V
Równanie to dotyczy gazów rzeczywistych i uwzględnia:
- przyciąganie pomiędzy cząsteczkami (stała a)
- objętość wyłączoną z ruchu cząsteczek (stała b)