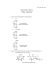atom glukozy
Transkrypt
atom glukozy
Weglowodany Nazwa pochodzi od wzoru sumarycznego: Cx (H2O)y „wodziany węgla” Ogólnie definiuje się je jako: polihydroksy aldehydy i polihydroksy ketony lub jako substancje, które w wyniku hydrolizy dają polihydroksy aldehydy lub polihydroksy ketony. Najprostsze węglowodany, takie które nie mogą być już hydrolizowane do prostszych węglowodanów noszą nazwę : „cukry proste” – „monosacharydy”. Węglowodany, które po hydrolizie dają: dwa cukry proste (molowo) disacharydy 3 trisacharydy itd. Oligosacharydy do 10 cukrów prostych Polisacharydy >10 Disacharydy: maltoza glukoza + glukoza sacharoza glukoza + fruktoza laktoza galaktoza + glukoza celobioza glukoza + glukoza Polisacharydy skrobia celluloza amyloza amylopektyna Monosacharydy Są klasyfikowane wg: ilości atomów węgla w cząsteczce: 3 trioza 4 tetroza 5 pentoza 6 heksoza 7 heptoza 8 oktoza czy zawierają grupę aldehydową czy ketonową Te dwa sposoby często się łączy : np. aldotetroza, aldoza ketoza ketoheksoza Monosacharydy Najprostsze cukry to triozy: CHO CHOH CH2OH aldotrioza aldehyd glicerynowy CHO H OH CH2OH ald. D-glicerynowy Dawniej d – oznaczało skręcalność (+) l – skręcalność (-) (R)-(+)-2,3-dihydroksypropanal CH2OH CO CH2OH ketotrioza dihydroksyaceton x CHO HO H CH2OH L-glicerynowy Konfiguracja względna D i L Szereg D- i L- cukrów. Cukier zaliczamy do szeregu D- jeżeli chiralny atom węgla C* o najwyższym numerze (najniżej narysowany w projekcji Fischera ) ma taką samą konfigurację jak aldehyd D-glicerynowy. Cukier zaliczamy do szeregu L- jeżeli chiralny atom węgla C* o najwyższym numerze (najniżej narysowany w projekcji Fischera ) ma taką samą konfigurację jak aldehyd L-glicerynowy. CHO OH CH2OH D-aldoheksoza CHO HO CH2OH L-aldoheksoza Synteza Kilianiego - Fischera aldehyd D-(+)-glicerynowy D-(-)-erytroza CHO H OH CH2OH CHO H OH H OH CH2OH CHO H OH H OH H OH CH2OH D-(-)ryboza CHO HO H H OH H OH CH2OH D-(-)-arabinoza CHO HO H H OH CH2OH CHO H OH HO H H OH CH2OH D-(-)-treoza CHO HO H HO H H OH CH2OH D-(+)-ksyloza D-(-)-liksoza D-(-)-ryboza H H H H CHO H OH H OH H OH CH2OH CHO OH OH OH OH CH2OH D-(+)-alloza HO H H H CHO H OH OH OH CH2OH D-(+)-altroza CHO HO H H OH H OH CH2OH H HO H H CHO OH H OH OH CH2OH D-(+)-glukoza HO HO H H D-(-)-arabinoza CHO H H OH OH CH2OH D-(+)-mannoza CHO H OH HO H H OH CH2OH D-(+)-ksyloza H H HO H CHO OH OH H OH CH2OH D-(+)-guloza HO H HO H CHO H OH H OH CH2OH D-(-)-idoza CHO HO H HO H H OH CH2OH H HO HO H CHO OH H H OH CH2OH HO HO HO H D-(-)-liksoza CHO H H H OH CH2OH D-(+)-galaktoza D-(+)-taloza D-glukoza H HO H H CHO OH H OH OH CH2OH CHO OH HO CHO OH HO OH OH CH2OH OH OH CH2OH 1,3-dihydroksypropanon CH2OH CO H OH CH2OH D-erytruloza CH2OH CO H OH H OH CH2OH D-rybuloza CH2OH CO H OH H OH H OH CH2OH D-alluloza CH2OH CO CH2OH CH2OH CO HO H H OH H OH CH2OH D-fruktoza Ketozy CH2OH CO HO H CH2OH L-erytruloza CH2OH CO HO H H OH CH2OH D-ksyluloza CH2OH CO H OH HO H H OH CH2OH D-sorboza CH2OH CO HO H HO H H OH CH2OH D-tagatoza Epimery – stereoizomery sacharydów różniące się położeniem tylko jednej grupy –OH Epimerem C2 D-glukozy jest D-mannoza, a epimerem C4 D-glukozy jest D-galaktoza 1CHO 2 OH HO 3 4 OH 5 OH 6 CH2OH D-glukoza CHO HO HO OH OH CH2OH D-mannoza HO HO CHO OH OH CH2OH D-galaktoza Enancjomerem D-glukozy jest L-glukoza CHO OH CHO HO HO OH OH OH CH2OH D-glukoza HO HO CH2OH L-glukoza a enancjomerem D-gulozy kest L-guloza CHO OH OH CHO HO HO HO OH OH CH2OH D-guloza HO CH2OH L-guloza W monosacharydach cukier o otwartym łańcuchu jest w równowadze z dwiema formami cyklicznymi – hemiacetalowymi. Cykliczne hemiacetale są uprzywilejowaną formą istnienia monosacharydów w roztworach i jedyną ich formą w stanie krystalicznym. CH2OH O OH OH OH OH CHO OH HO OH OH CH2OH CH2OH O OH OH OH OH Zamknięcie pierścienia wytwarza nowe centrum asymetrii na karbonylowym atomie węgla – tu C1 6 CH2OH O OH 5 4 OH 2 1 OH 3 OH 1 CHO 2 OH HO 3 4 OH 5 OH 6 CH2OH 6 CH2OH O 5 1 4 OH 2 OH OH 3 OH Te dwa cykliczne diastereoizomery różnią się jedynie konfiguracją na węglu C1 (byłym karbonylowym). Węgiel ten nosi nazwę węgla anomerycznego a te dwa diastereoizomery to anomery α i β. 1 CH2OH O OH OH 1 OH OH CHO OH CH2OH O 1 OH OH OH OH HO OH OH CH2OH anomer β anomer α Czasami wygodnie jest nie zaznaczać z jakim anomerem mamy do czynienia , zapisujemy wówczas CH2OH O OH OH OH OH Proces tworzenia pierścienia hemiacetalowego Pierścienie 5 – członowe to furanozy 6 – członowe to piranozy CHO OH CHO OH HO HO OH OH CH2OH OH OH CH2OH furanoza piranoza CH2OH O OH HO CH2OH OH OH OH OH anomer α α -D-glukopiranoza O OH OH anomer α α -D-glukofuranoza CHO OH OH HO HOCH2 OH OH CH2OH HO CH2OH HOCH2 C OHOH OH H HOCH2 C OH O O H OH OH OH C O C OHOH OH H O H OH CH2OH CH2OH OH OH O OH OH O OH OH anomer α α -D-glukopiranoza OH OH anomer β β -D-glukopiranoza Mutarotacja Mutarotacja – zmiana skręcalności roztworów cukrów Mutare -zmieniać α-D-glukopiranoza ma tt = +146oC i [α] = +112o. β-D-glukopiranoza ma tt = +150oC i [α] = +18,7o. Roztwór α-D-glukopiranozy o początkowym [α] = +112o powoli zmniejsza [α] aż do osiągnięcia wartości równowagowej [α] = +52,5o Roztwór β-D-glukopiranozy o początkowym [α] = +18,7o powoli zwiększa [α] aż do osiągnięcia wartości równowagowej [α] = +52,5o Mutarotacja jest wynikiem równowag tautomerycznych ustalających się w roztworach sacharydów. Ta równowaga może dotyczyć również wielkości pierścienia. 1 CHO OH CH2OH O OH OH 1 OH OH CH2OH O 1 OH OH OH OH HO OH OH CH2OH anomer β HO anomer α CH2OH OH O 1 OH OH anomer α HO CH2OH OH OH O 1 OH anomer β Skręcalność właściwa glukozy [α] = +52,5o jest średnią udziałów wszystkich form. Pomijając formę otwartołańcuchową ( 0,02% ) i formę furanozową można wyliczyć udział anomeru α (x ) i β (y). (+112o) x + (+18,7o) y = +52,5o x + y = 100% α-D-glukopiranoza – 36% β-D-glukopiranoza – 64% β-D-glukopiranoza jest jedyną aldoheksozą, w której wszystkie grupy –OH i grupa –CH2OH zajmują położenia ekwatorialne. CH2OH CH2OH OH OH O OH OH O OH OH OH anomer β HOCH2 e HO e HO e anomer α O e OH OH e OH HOCH2 e HO e HO e O e OH a OH Reakcje sacharydów 1. Tworzenie glikozydów HO CHO OH OH OH CH2OH x CH2OH CH2OH O OCH3 CH3OH HCl OH OH O + OH OH OH α-D-me tylo g luko pirano zyd Acetale węglowodanów - glikozydy Acetal glukozy mannozy Ketal fruktozy CH2OH OH O OH OCH3 α-D-me tylo g luko pirano zyd glukozyd mannozyd fruktozyd OCH3 CH2OH OH OH β-D-me tylo rybo furano zyd O CH2OH OCH3 OH α-D-me tylo frukto furano zyd 2. Utlenianie sacharydów . A. Wiele odczynników utleniających używanych jest w chemii cukrów celem wyjaśnienia ich budowy: Odczynnik Fehlinga – winianowy kompleks Cu2+w środowisku zasadowym Odczynnik Tollensa – amoniakalny roztwór azotanu (V) srebra Odczynnik Benedicta – cytrynian Cu2+ w zasadowym środowisku Utleniają aldehydy i α-hydroksyketony. Dają pozytywny wynik dla wszystkich aldoz i ketoz. Wszystkie cukry zawierające grupę hemiacetalową lub hemiketalową dadzą pozytywny wynik gdyż są w równowadze z formą łańcuchową. Acetale i ketale nie dają pozytywnego wyniku gdyż są trwałe w zasadowym środowisku reagentów. Odczynniki te mają znaczenie diagnostyczne (odczynnik Benedicta można stosować do ilościowego oznaczenia cukru w moczu i krwi) ale nie mają znaczenia preparatywnego. B. Synteza kwasów aldonowych Woda bromowa Br2 / H2O selektywnie utlenia –CHO do –COOH CHO OH HO OH OH CH2OH D-glukoza Br2 H2O COOH OH HO OH OH CH2OH kwas D-glukonowy x C. Synteza kwasów aldarowych Rozcieńczony HNO3, silniejszy utleniacz, utlenia –CHO i ostatnią grupę –CH2OH. Powstaje kwas dikarboksylowy. CHO OH HO OH OH CH2OH D-glukoza COOH OH HNO3 HO OH OH COOH kwas D-glukarowy x kwas cukrowy 3. Redukcja sacharydów – synteza alditoli CHO OH HO OH OH CH2OH 1. NaBH4 CH2OH OH HO OH OH CH2OH 2. H2O D-glucitol x sorbit sorbitol D-glukoza 4. Reakcja z fenylohydrazyną – osazony CHO OH HO OH OH CH2OH D-glukoza H 3 C6H5NHNH2 HO C N NH C6H5 C N NH C6H5 OH OH CH2OH + C6H5NH2 + NH3 + H2Ox fenyloosazon D-glukozy Rodzaj związku Nazwa ogólna Nazwa szczegółowa Nazwa szczegółowa monosacharyd aldoza glukoza mannoza kwas monokarboksylowy kwas aldonowy kwas glukonowy kwas mannonowy kwas dikarboksylowy kwas aldarowy kwas glukarowy kwas mannarowy alkohol wielowodorotlenowy alditol glucitol (sorbit) mannitol Disacharydy HOH2C HO HO α-D-glukopiranoza HOH2C HO HO O OH OH HOH2C HO HO O OH OH D-glukopiranoza O OH O HOH2C 4 5 HO 3 O 2 OH 1 anomer α OH 4-O-(α-D-glukopiranozylo)-α-D-glukopiranoza maltoza Disacharydy HOH2C HO HO O HOH2C OH HO HO OH O OH OH β-D-glukopiranoza D-glukopiranoza HOH2C HO HO O HOH2C O OH HO O OH OH 4-O-(β-D-glukopiranozylo)- α-D-glukopiranoza celobioza anomer α Disacharydy OH HOH2C HO O HOH2C OH HO HO OH O OH OH β-D-galaktopiranoza D-glukopiranoza OH HOH2C HO O HOH2C O OH HO O OH OH 4-O-(β-D-galaktopiranozylo)- β-D-glukopiranoza laktoza anomer β Disacharydy HOH2C HO HO O α-D-glukopiranoza OH OH CH2OH OH O CH2OH OH HOH2C HO HO O sacharoza 2 1 3 CH2OH O OH β-D-fruktofuranoza OH OH O 1-O-(β-D-fruktofuranozylo)- α-D-glukopiranoza OH 2 2-O- (α-D-glukopiranozylo)- β-D-fruktofuranoza 3 CH2OH 1 Jeżeli tak jak dla sacharozy, w tworzeniu wiązania glikozydowego uczestniczą grupy hemiacetalowe z obu cząstreczek cukrów, to powstaje disacharyd nieredukujący, który nie daje także innych reakcji charakterystycznych dla hemiacetali (np. mutarotacji). Wszystkie disacharydy łatwo ulegają hydrolizie katalizowanej przez kwasy, tworząc składowe cukry proste. Oligosacharydy Cyklodekstryny. Są cyklicznymi oligomerami glukozy zawierającymi 6 α-cyklodekstryna 7 β-cyklodekstryna 8 χ-cyklodekstryna cząsteczek tego cukru w pierścieniu i połączonych wiązaniami 1,4-α-glikozydowymi. OH OH O OH OH O O CH2OH OH OH O CH2OH O O CH2OH OH OH OH OH OH OH OH OH OH OHOH OH O CH2OH O O CH2OH CH2OH Polisacharydy Skrobia – składa się z dwóch frakcji: rozpuszczalnej w wodzie amylozy i nierozpuszczalnej amylopektyny (w przewadze). HOH2C O O HO OH HOH2C O HO O OH HOH2C O O HO OH HOH2C O O HO OH amyloza 100 – 500 cząsteczek D-glukozy, wiązania α-glikozydowe 1,4 HOH2C O HO O OH O Polisacharydy HOH2C O O HO OH HOH2C O O O HO HO OH O HOH2C HOH2C O HO OH O OH O HOH2C O HO HOH2C O OH O HO OH CH2 O O wiązanie α-glikozydowe 1,6 O HO OH amylopektyna 10 – 30 cząsteczek D-glukozy, ale rozgałęzione łańcuchy HOH2C O HO O OH O Polisacharydy Glikogen – ma budowę zbliżoną do amylopektyny, jest tylko większy i bardziej rozgałęziony Celuloza HOH2C O HO O HOH2C O OH HO O HOH2C O OH HO O HOH2C O OH HO wiązanie β-glikozydowe 1,4 Chityna CH2OH CH2OH O O OH O O NaOH OH O O NHCCH3 NH2 O chitozan O OH O O-glikozydy Cząsteczka cukru przez atom tlenu łączy się z cząsteczką niecukrową - aglikonem HOH2C HO HO O O aglikon OH N-glikozydy Najbardziej znane to nukleozydy występujące w DNA i RNA aglikon CH2OH O H N H H H OH OH RNA H DNA Glikozydy w naturze Amig dalina w gorzkich migda ła ch, hydroliza * uwa lnia HCN CH2OH O OH O CH2 O OH HO HO HO HO COO OH CH2OSO3 O OH O O O OSO3 C N O CH β * emulsyna O NHSO3 Heparyna - sulfonowany glukozaminoglukanu, naturalneg czynnika przeciwzakrzepowego [fragment łańcucha] P rze ds ta wicie l glikoza minoglika nów zwa nych wcze ś nie j mukopolis a cha ryda mi.