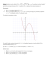(1) i
Transkrypt
(1) i
Biotechnologia - chemia fizyczna/ Termodynamika techniczna i chemiczna – zadania egzaminacyjne
1
ZADANIA EGZAMINACYJNE Z TERMODYNAMIKI
z rozwiązaniami (z lat 1999-2005)
1. Mieszaninę dwóch ciekłych składników (1) i (2) chcemy rozdzielić przez destylację. Dla T = 298 K jest to
układ azeotropowy. W jakiej temperaturze należy przeprowadzić destylację, aby rozdzielenie obu składników
było możliwe? Prężności par czystych są następującą funkcją temperatury
lnpio = Ai /T + Bi
i = 1,2
Ciekły roztwór można opisać modelem roztworu prostego (GE = Gx1x2, gdzie G = RaT; Dla roztworu prostego
współczynniki aktywności wynoszą : RTlnγ1 = Gx22; RTlnγ2 = Gx12).
Rozwiązanie: Warunkiem koniecznym jest brak azeotropu, a więc stan, w którym równanie
p1o/p2o = γ2/ γ1 NIE będzie spełnione.
Przedstawiając w postaci zlogarytmowanej otrzymujemy
ln(p1o/p2o) = ln(γ2/ γ1) ⇒ (A1/T + B1)/ (A2/T + B2) = a(x12 - x22) = a(x1 - x2)(x1 + x2) = a(x1 - x2) = a(2x1 - 1)
Po kolejnych przekształceniach
A1 + B1T
x1 = 21 +
2a ( A2 + B2 T )
Aby powyższe równanie NIE było spełnione (a tym samym NIE istniał azeotrop), obliczony ułamek molowy musi
mieć wartość poza dopuszczalnym przedziałem, tj.
x1 < 0 lub x1 > 1
Co jest spełnione dla
A1 + B1T
>1
a ( A2 + B2 T )
Destylację zatem należy przeprowadzić w zakresie temperatur spełniającym powyższą nierówność. Można
uzyskać bardziej szczegółowe warunki, ale wymaga to rozważenia wszystkich kombinacji znaków wyrażeń (A1/T
+ B1), (A2/T + B2) i a.
2. Związek A występuje w dwóch formach - jako monomer (A) i dimer (A2). Dla reakcji dimeryzacji zachodzącej
w fazie gazowej i pod umiarkowanymi ciśnieniami
2A(g) = A2(g)
stała równowagi wynosi K* w temperaturze T* a standardowa entalpia - ∆H°. Można założyć, że ta ostatnia nie
zależy od temperatury. Przedstaw zależność zawartości dimeru w A, w procentach objętościowych, w funkcji
temperatury.
Rozwiązanie:
A
A2
Σni
nio
1
0
ni(ξ)
1 - 2ξ
ξ
1-ξ
xi(ξ)
(1 - 2ξ)/(1 - ξ)
ξ/(1 - ξ)
ξ (1 − ξ ) p o
=K
(1 − 2ξ ) 2 p
Pierwiastek względem ξ (0 ≤ ξ ≤ 1/2) wynosi
ξ = 1/2 [1 - (4Kp°/p + 1)-1/2]
Stąd procent objętościowy dimeru
% = 100ξ/(1 - ξ) = 100⋅[(4Kp°/p + 1)1/2 - 1]/ [(4Kp°/p + 1)1/2 + 1]
gdzie K = K*exp[-∆H°/R(1/T - 1/T*)]
3. Eksperymentalnie znaleziono następującą zależność prężności pary nasyconej pewnej substancji od
temperatury
ln(p/1 bar) = A + B/T + ClnT
Biotechnologia - chemia fizyczna/ Termodynamika techniczna i chemiczna – zadania egzaminacyjne
2
Znaleźć zależność entalpii parowania od temperatury.
Rozwiązanie:
Z równania Clapeyrona (przy założeniu doskonałości fazy gazowej i przy pominięciu objętości fazy ciekłej)
mamy
∂ ln p
∆H par = RT 2
∂T
Stąd
B C
∆H par = RT 2 − 2 + = R(CT − B )
T
T
4. Stwierdzono eksperymentalnie, że stała równowagi pewnej reakcji zależy od temperatury zgodnie z funkcją
lnK = A/T + B + ClnT
Jednocześnie stwierdzono, że położenie stanu równowagi nie zmienia się wraz ze zmianami ciśnienia. Znaleźć
zależność temperaturową standardowej entalpii, standardowej entropii i standardowej zmiany objętości tej
reakcji .
Rozwiązanie: Z definicji K uzyskujemy
∆G°=-R(A + BT + CTlnT)
Pozostałe funkcję otrzymamy z:
∆S° = - (∂∆G°/∂T)p
∆H° - z równania Gibbsa-Helmholtza, lub też z ∆H°= ∆G + T∆S°
∆V°= 0, o czym świadczy brak wpływu ciśnienia na położenie stanu równowagi.
5. Jaka będzie postać zależności p = f(T) dla krzywej parowania, jeśli założy się następujący wpływ temperatury
na entalpię parowania:
∆Hpar = a(T-1- Tk-1) a ≠ f(T,p); a > 0 Tk jest temperaturą krytyczną
podczas gdy zachowane będą w mocy pozostałe założenia prowadzące do równania Clausiusa-Clapeyrona?
Rozwiązanie: Z równania Clapeyrona
∂ p
a ( T −1 − Tk−1 ) p
=
RT 2
∂ T sat
Po rozdzieleniu zmiennych
dp a −3
=
T − T −2 / Tk dT
p R
(
)
i po scałkowaniu otrzymujemy ostateczne równanie
p
R ln 2 = − a 2(T2−2 − T1−2 ) + (T2−1 − T1−1 ) / Tk
p1
[
]
6. Wyznaczono eksperymentalnie następującą zależność objętości pewnej cieczy od ciśnienia i temperatury
V = nVo[1 + aT(T-To) + bT(T-To)2][1 + ap(p-po) + bp(p-po)2]
gdzie Vo jest objętością molową dla T = To i p = po.
Obliczyć zmianę ciśnienia podczas izochorycznego ogrzewania próbki cieczy od temperatury T1 do T2.
Rozwiązanie: Podstawą jest pochodna (∂p/∂T)V = - (∂V/∂T)p/(∂V/∂p)T
(∂V/∂T)p = nVo[ aT + 2bT(T-To)][1 + ap(p-po) + bp(p-po)2]
(∂V/∂p)T = nVo[1 + aT(T-To) + bT(T-To)2][ ap + 2bp(p-po)]
stąd
[ aT + 2bT (T - To )][1 + a p (p - po ) + bp (p - po )2 ]
∂ p
=−
[1 + aT (T - To ) + bT (T - To )2 ][ ap + 2bp (p - po )]
∂ T V
Biotechnologia - chemia fizyczna/ Termodynamika techniczna i chemiczna – zadania egzaminacyjne
3
Rozdzielając zmienne i całkując w granicach (T1 → T2; p1 → p2) otrzymamy szukaną zmianę (policzenie całki
wymaga tablic całek funkcji wymiernych; wystarczy napisać funkcje podcałkowe).
7. Substancja A ma temperaturę wrzenia To pod ciśnieniem po. Podwyższenie ciśnienia k razy powoduje
zwiększenie temperatury o ∆T. Napisać równanie krzywej parowania.
Rozwiązanie: Informacja zawarta w zadaniu może być interpretowana jako znajomość dwóch punktów na
krzywej parowania - (po,To), (kpo,To + ∆T). Tak więc może służyć do wyznaczenia najwyżej dwuparametrowego
równania krzywej parowania, czyli równania Clausiusa-Clapeyrona.
ln( p / po ) = −
∆H par
R
(1 / T − 1 / To )
Entalpię parowania można wyznaczyć z drugiego punktu, tj.
ln k = −
∆H par 1
− 1 / To
R T + ∆T
Ostatecznie krzywa parowania będzie miała postać
ln( p / po ) =
ln k (1 / T − 1 / To )
1
− 1 / To
T + ∆T
8. Obliczyć współczynniki: rozszerzalności temperaturowej i ściśliwości dla gazu doskonałego i gazu
opisywanego równaniem wirialnym obciętym do drugiego współczynnika.
Rozwiązanie: Wyrażając V = V(T,p) na podstawie (a) równania stanu gazu doskonałego - V = nRT/p; (b)
równania wirialnego - V = n(RT/p + B) i licząc odpowiednie pochodne, otrzymujemy
α = 1/T - gaz doskonały
κ = 1/p
- gaz doskonały
α = (R + pdB/dT)/(RT + Bp) - gaz spełniający wirialne równanie stanu
κ = RT/[p(RT + Bp)
- gaz spełniający wirialne równanie stanu
9. Nadmiarowa entalpia swobodna układu dwuskładnikowego (1) + (2) opisywana jest równaniem:
GE = (a1 + a2T)x1x2
[J/mol] a1,a2 ≠ f(T,p,x1)
Napisać równanie izotermy równowagi ciecz-para p = p(T = const, x1) dla tego układu oraz podać równanie
umożliwiające obliczenie składu fazy gazowej, jeśli znane są: p,T i skład fazy ciekłej (x1). Jeśli przedstawione
równania nie są ścisłe termodynamicznie, podać założenia upraszczające, które muszą być spełnione aby mogły
być one (tj. równania) stosowane.
Wskazówka: Dla roztworu prostego (tj. gdy GE = A(T)x1x2), współczynniki aktywności dane są poprzez: RTlnγ1 =
Ax22 ; RTlnγ2 = Ax12
Rozwiązanie: Wyrażenia na współczynniki aktywności będą
a +a T
γ 1 = exp 1 2 x22
RT
Stąd równanie izotermy
a +a T
γ 2 = exp 1 2 x12
RT
a + a2 T 2
a + a2 T 2
p = p1o x1 exp 1
x 2 + p2o x2 exp 1
x1
RT
RT
Skład fazy gazowej obliczy się z równania
a +a T
y1 = p1o x1 exp 1 2 x22 / p
RT
uproszczenia:
1. Doskonałość fazy gazowej
2. Pomijalność ułamka Poyntinga
10. Prężność pary nasyconej nad pewną substancją czystą wyraża się następującym równaniem
p = a + bT + cT2 [N/m2]
Obliczyć entalpię parowania tej substancji pod ciśnieniem p = po.
Biotechnologia - chemia fizyczna/ Termodynamika techniczna i chemiczna – zadania egzaminacyjne
4
Rozwiązanie: Z równania Clapeyrona zastosowanego do równowagi ciecz-para i przy założeniu upraszczającym
∆V = RT/p otrzymujemy
∆Hpar = (RT2/p)(dp/dT) = RT°2(b + 2cT°)/p°
Temperaturę T° (temperaturę wrzenia pod ciśnieniem p°) oblicza się z rozwiązania równania krzywej
parowania dla p = p°, tj.
T° = {[b2 - 4c(a-p°)] 1/2 - b}/2c
(spośród dwóch pierwiastków, prawidłowy jest ten większy)
11. Reagenty reakcji chemicznej typu A = B (np. izomeryzacja) charakteryzują się następującymi
standardowymi entalpiami tworzenia (∆Hf°) i entropiami (S°) w temperaturze 298 K oraz zależnościami
temperaturowymi pojemności cieplnych (cp°):
cp°
∆Hf ° S°
A
HA
SA
cA ≠ f(T)
B
HB
SB
cB ≠ f(T)
Przedstawić zależność temperaturową stopnia przemiany (α) substancji A od temperatury. (Stopniem przemiany
nazywamy stosunek ilości substratu, który przereagował, do początkowej jego ilości).
Rozwiązanie:
nio
1
0
xi(ξ)
ni(ξ)
A
1-ξ
1-ξ
B
ξ
ξ
1
Σni
α = (1 - ξ)/1 = 1 - ξ
ξ/(1 - ξ) = K ⇒ ξ = 1/(1 + K) ⇒ α = K/(K+1)
Stała równowagi:
K = exp(-∆G°/RT) = exp(-∆H°/RT + ∆S°/R)
T
∫ (c
∆H o (T ) = HB − H A +
B
− c A )dT = H B − H A + (cB − c A )(T − 298)
298
T
∆S o (T ) = S B − S A +
cB − c A
T
dT = S B − S A + (cB − c A ) ln
T
298
298
∫
[
T
K = exp( − ∆G o / RT ) = exp ( S B − S A − ( H B − H A ) / T + ( cB − c A )[ln 298
− R (1 − 298
T )]) / R
]
Odp. α = K/(K+1), gdzie K = f(T) wyrażone jest powyższym równaniem
12. Prężności par nasyconych nad czystymi składnikami A i B, mogą być wyrażone w postaci:
pio = aiT 2 gdzie i = A, B
w interesującym nas przedziale temperatur. Mieszanina ciekła A + B jest praktycznie roztworem doskonałym.
Podać i naszkicować orientacyjnie równania izobary (dla p = p°) równowagi ciecz-para dla tego układu (tzn.
zależności T = f(xA) i T = f(yA), czyli temperatura wrzenia w funkcji składu fazy ciekłej i składu fazy gazowej).
Rozwiązanie: Po podstawieniu do równań równowagi ciecz-para wyrażeń na prężności pary nasyconej nad
czystymi składnikami
p°yA= aAT2xA
p°yB= aBT2xB
p°= aAT2xA + aBT2xB
Z ostatniego równania
1/ 2
−1/ 2
po
−2
−2
T =
= TA x A + TB x B
a A x A + aB xB
gdzie TA, TB są temperaturami wrzenia czystych składników pod ciśnieniem p°.
Wyznaczając xA z drugiego równania i podstawiając do pierwszego, otrzymamy izobarę T = f(yA).
(
)
Biotechnologia - chemia fizyczna/ Termodynamika techniczna i chemiczna – zadania egzaminacyjne
(
T = po y A / a A + po yB / aB
1/ 2
)
(
= TA2 y A + TB2 x B
5
1/ 2
)
13. Dla reakcji izomeryzacji zachodzącej w fazie gazowej i pod umiarkowanymi ciśnieniami
A=B
stała równowagi wynosi K° w temperaturze T° a standardowa entalpia - ∆H°. Można założyć, że ta ostatnia nie
zależy od temperatury. Przedstawić zależność stosunku stężeń równowagowych obu izomerów (A/B) od
temperatury.
Rozwiązanie:
Z izobary van’t Hoffa wynika następująca zależność temperaturowa stałej równowagi
ln(K/K°) = -∆H°(1/T-1/T°)/R
W stanie równowagi
xB/xA = K ⇒ xA/xB =1/ K
gdzie K(T) = K°exp[-∆H°(1/T-1/T°)/R]
Najwygodniej zależność xA/xB = f(T) przedstawić w postaci logarytmicznej
ln(xA/xB) = -lnKo+∆H°(1/T-1/T°)/R
14. Prężność pary nasyconej nad pewną substancją czystą wyraża się następującym równaniem
p = a + bT [N/m2]
Obliczyć entalpię parowania tej substancji pod ciśnieniem p = po.
Sposób rozwiązania taki sam jak w zadaniu 10.
15. Obliczyć zmianę entropii dla procesu, w którym 1 mol gazu doskonałego zostanie poddany przemianie: (T1
,p1 ) → (T2 ,p2 ). Pojemność cieplna gazu dana jest równaniem:
cp = a + bT + cT2 [J/mol⋅K]
Wskazówka: Jedną z potrzebnych pochodnych można otrzymać z relacji Maxwella zastosowanej do różniczki
zupełnej entalpii swobodnej - tj. dG = -SdT + Vdp
Rozwiązanie:
Potrzebne pochodne to (∂S/∂T)p=cp/T oraz (∂S/∂p)T = -(∂V/∂T)p (ta druga pochodna wynika z relacji Maxwella)
Po scałkowaniu mamy
T2
p2
dp
p
p1
∆S = ∫ (a + bT + cT 2 )dT + RT2 ∫
T1
czyli ∆S = a(T2-T1) +1/2(T22-T12) + 1/3(T23-T13) +RT2ln(p2/p1)
16. Znaleźć związek pomiędzy temperaturą topnienia substancji czystej a ciśnieniem, przyjmując prawdziwość
następujących założeń:
• entalpia topnienia nie zależy od temperatury
• różnica objętości fazy ciekłej i stałej w temperaturze topnienia jest następującą funkcją ciśnienia
∆Vtop = ao + a1p
Niezależność entalpii topnienia od ciśnienia wynika z powyższych założeń. Dodatkowe 3 (trzy) punkty otrzyma
ta osoba, która uzasadni to stwierdzenie.
Biotechnologia - chemia fizyczna/ Termodynamika techniczna i chemiczna – zadania egzaminacyjne
6
Rozwiązanie: Równanie Clapeyrona
∆ Htop
∂ p
=
∂ T sat ( ao + a1 p) T
po rozdzieleniu zmiennych i scałkowaniu prowadzi do zależności
ao(p2-p1) + 1/2a1(p22 - p12) = ∆Htopln(T2/T1)
Skoro entalpia topnienia nie jest funkcją temperatury, to musi także być niezależna od ciśnienia, ponieważ te
dwa parametry są związane ze sobą w stanie równowagi. Inaczej mówiąc, jeśli zmienia się temperatura (a
entalpia topnienia pozostaje stała), to także musi zmieniać się ciśnienie.
17. N moli gazu dającego opisać się równaniem stanu van der Waalsa tj.
(p + a/V2)(V - b) = RT , gdzie V oznacza objętość molową
sprężonych początkowo do ciśnienia p1 większego od ciśnienia atmosferycznego po, rozpręża się po otwarciu
zbiornika do atmosfery. Obliczyć pracę wykonaną przez ekspandujący gaz w warunkach izotermicznych.
Rozwiązanie: Ze względu na stałe ciśnienie zewnętrzne, praca jest nieodwracalna. A zatem
dw = -pzdV i
w = -po(V2-V1)
gdzie V2 i V1 są rozwiązaniami równania van der Waalsa kolejno dla (T,po) i (T,p1).
18. Obliczyć temperaturę, w której skład azeotropowy dla układu dwuskładnikowego (1+2) wynosi x1 = a.
Mieszaninę można opisać modelem roztworu prostego w postaci: GE = Ax1x2, gdzie A ≠ f(T) (dla roztworu
prostego współczynniki aktywności równają się: RTlnγ1 = Ax22 ; RTlnγ2 = Ax12). Normalne temperatury wrzenia
dla czystych składników wynoszą kolejno: Tw1, Tw2 a entalpie parowania: ∆Hp1 i ∆Hp2.
Rozwiązanie: Na podstawie termodynamicznego warunku istnienia azeotropu
p1o/p2o = γ2/ γ1
zastosowanego do roztworu prostego otrzymujemy
ln(p1o/p2o) = ln(γ2/ γ1) ⇒ ln(p1o/p2o) = A(x12 - x22)/RT = A(x1 - x2)(x1 + x2)/RT = A(x1 - x2)/RT = A(2x1 - 1)/RT
Stąd skład azeotropowy x1 wynosi
x1 = 1/2 + (RT/A)⋅ ln(p1o/p2o) = a
na postawie posiadanych danych, prężność par nasyconych nad czystymi składnikami można wyrazić poprzez
równanie Clausuiusa-Clapeyrona, tj.
ln(p1o/po) =-∆Hp1/R(1/T - 1/Tw1)
ln(p2o/po) =-∆Hp2/R(1/T - 1/Tw2)
i po odjęciu stronami
(RT/A)ln(p1o/p2o) =[∆Hp2 - ∆Hp1 - T(1/Tw2 - 1/Tw1 )]/A = a - 1/2
Z powyższego równania należy wyznaczyć szukaną temperaturę. Zwracam uwagę, że prężności par nad czystymi
składnikami (pio) są funkcjami temperatury (np. w formie równania Antoine’a).
19. Znaleźć związek pomiędzy temperaturą wrzenia substancji czystej a ciśnieniem, przyjmując prawdziwość
następujących założeń:
• entalpia parowania jest następującą funkcją temperatury: ∆Hpar =K(Tk – T) gdzie Tk jest temperaturą
krytyczną
Biotechnologia - chemia fizyczna/ Termodynamika techniczna i chemiczna – zadania egzaminacyjne
•
•
7
objętości cieczy jest pomijalnie mała w stosunku do objętości pary
para może być opisana równaniem wirialnym obciętym do drugiego współczynnika, który zależy od
temperatury wg równania : B = a + bT
Rozwiązanie: Z drugiego i trzeciego założenia wynika, że zmiana objętości podczas parowania będzie wynosić
∆Vpar = RT/p + a + bT
Na podstawie równania Clapeyrona
∆H par
∂ p
K (Tk / T − 1)
K (Tk / T − 1)
=
=
=
∂ T sat T∆V par RT / p + a + bT T ( R / p + b) + a
Aby otrzymać zależność p = f(T) należy scałkować powyższe równanie. Niestety, nie da się rozdzielić zmiennych.
Tak więc całkowanie może być tylko numeryczne.
20. Kawałek metalu o gęstości wynoszącej do pod ciśnieniem po, spręża się izotermicznie za pomocą prasy o
powierzchni A, dającej nacisk (siłę) F. Obliczyć gęstość sprężonego metalu. Jeśli potrzebne są dodatkowe dane,
proszę je nazwać i uznać, że są dostępne.
Rozwiązanie: Problem sprowadza się w istocie do znalezienia zmiany objętości w wyniku sprężenia. Mamy
bowiem
d1/do = Vo/V1
Stosunek objętości znajdziemy poprzez scałkowanie współczynnika ściśliwości
(∂lnV/∂p)T = -κ i
V1/Vo = exp[-κ(p1-po)]
Ciśnienie wywierane przez prasę wynosi F/A.
Ostatecznie więc
d1= do exp[κ(F/A-po)]
21. Obliczyć zależność składu mieszaniny, w której zachodzi reakcja izomeryzacji A(g) = B(g)
od temperatury, dysponując podstawowymi danymi termodynamicznymi (jakimi?). Założyć dla uproszczenia, że
standardowa zmiana pojemności cieplnych dla tej reakcji równa się zeru.
Rozwiązanie:
xB/xA = (1- xA )/xA = K = exp(-∆H°/RT + ∆S°/R)
ułamek molowy A w funkcji temperatury będzie wynosił
xA =
exp(− ∆H o / RT + ∆S o / R )
1 + exp(− ∆H o / RT + ∆S o / R)
22. Wyznaczono eksperymentalnie następującą zależność objętości pewnego ciała stałego od ciśnienia i
temperatury
V = nVo[1 + aT(T-To) + bT(T-To)2][1 + ap(p-po) + bp(p-po)2]
gdzie Vo jest objętością molową dla T = To i p = po.
Obliczyć pracę wykonaną przez 1 mol (n=1) substancji podczas izobarycznego ogrzewania (p = 1 bar) od
temperatury T1 do T2.
Rozwiązanie:
Praca w warunkach izobarycznych będzie wynosić
dw = -pdV, czyli w = -p(V2 - V1)
Biotechnologia - chemia fizyczna/ Termodynamika techniczna i chemiczna – zadania egzaminacyjne
8
Tak więc problem sprowadza się do znalezienia zmiany objętości podczas izobarycznego ogrzewania, co można
zrobić po prostu obliczając objętości dla dwóch różnych temperatur. Stąd
V2 - V1 = nVo[1 + ap(p-po) + bp(p-po)2] [aT(T2 -T1) + bT(T22 -T12 - 2To(T2-T1))]
23. Stały związek AB może rozpaść się według reakcji
AB(s) = A(s) + B(g)
Obliczyć temperaturę Tr , powyżej której AB nie jest trwałe w atmosferze o ciśnieniu całkowitym p i stałym
ułamku objętościowym gazu B wynoszącym yB. Przyjąć znajomość podstawowych danych termodynamicznych
dla wszystkich składników w temperaturze 298 K. Można założyć, że standardowa różnica pojemności cieplnych
dla reakcji równa się zeru.
Rozwiązanie: Związek nie będzie trwały jeśli
pB = pyB < p°K = p° exp(-∆H°/RT + ∆S°/R)
-∆H°/RT + ∆S°/R > ln(pyB/p°)
∆H° < T[∆S° - Rln(pyB/p°)]
T > ∆H°/[∆S° - Rln(pyB/p°)] dla ∆H° > 0
T < ∆H°/[∆S° - Rln(pyB/p°)] dla ∆H°< 0
24. Znaleźć współrzędne punktu eutektycznego dla dwuskładnikowego układu (1) + (2). Roztwór ciekły da się
opisać modelem roztworu prostego w następującej formie: (GE = Ax1x2, gdzie A = a/T oraz a nie zależy od
składu i temperatury; współczynniki aktywności wynoszą : RTlnγ1 = Ax22; RTlnγ2 = Ax12). W fazie stałej
występują jedynie czyste kryształy (1) lub (2). Dysponujemy wszystkimi potrzebnymi parametrami opisującymi
właściwości czystych składników (to znaczy jakimi ?)
Rozwiązanie: Aby znaleźć współrzędne punktu eutektycznego, należy znaleźć wspólny punkt dwóch krzywych
rozpuszczalności:
Rlnx1 = -∆Htop1/R⋅(1/T - 1/Ttop1) - x22 a/T2
Rlnx2 = -∆Htop2/R⋅(1/T - 1/Ttop2) - x12 a/T2
czyli rozwiązać powyższy układ równań względem (x1,T). Potrzebne dane to entalpie i temperatury topnienia dla
obu składników.
25. Sprężono 1 mol gazu doskonałego od ciśnienia p1 do p2 w stałej temperaturze T. Obliczyć zmianę entropii
układu i otoczenia jeśli: a) proces został przeprowadzony odwracalnie; b) nieodwracalnie przy stałym ciśnieniu
zewnętrznym p2 Temperatura otoczenia dla obu przypadków jest stała i wynosi T.
Wskazówka: Pochodną (∂S/∂p)T można uzyskać z relacji Maxwella zastosowanej do różniczki zupełnej entalpii
swobodnej, tj. dG = Vdp – SdT
Rozwiązanie:
Zmiana entropii układu.
Zgodnie z powyższą wskazówką
∂S
nR
∂V
∂p = − ∂T = − p
p
T
p2
∆S ukł = −nR ∫
p1
dp
p
= nR ln 1
p
p2
Zmiana ta jest taka sama dla procesu odwracalnego i nieodwracalnego (dlaczego?).
Dla procesu odwracalnego, sumaryczna zmiana entropii wynosi zero, stąd ∆Sot = -∆Sukł.
Zmiana entropii otoczenia w opisanych warunkach (stała T) równa się ∆Sot = -Q/T, co można wykorzystać przy
obliczaniu entropii otoczenia dla przemiany nieodwracalnej.
Izotermiczność procesu i charakter substancji (gaz doskonały), sprawiają, że ∆U = 0 i Q = -w.
Stąd
Biotechnologia - chemia fizyczna/ Termodynamika techniczna i chemiczna – zadania egzaminacyjne
∆S ot = −
Q w
p
p nRT nRT
= = − 2 (V2 − V1 ) = − 2
−
T T
T
T p2
p1
9
p
= nR 2 − 1
p1
26. Wyprowadzić związek pomiędzy temperaturą topnienia i ciśnieniem dla fazy czystej, zakładając liniową
zależność objętości molowych współistniejących faz od ciśnienia. Można założyć niezależność entalpii topnienia
od ciśnienia (i temperatury). Jak można oszacować wartość współczynników tej zależności?
Rozwiązanie:
Liniowa zależność objętości od temperatury, prowadzi do następującego związku
∆Vtop = ap + b
(26.1)
Stąd, z wykorzystaniem równania Clapeyrona
∆H top
∂p
=
∂T eq T (ap + b )
(ap + b )dp = ∆H top dT
T
1
T
2
2
a p2 − p1 + b( p2 − p1 ) = ∆H top ln 2
2
T1
(
)
( p2 − p1 ) 1 a( p2 + p1 ) + b = ∆H top ln T2
2
T1
Równanie (26.1) wynika z zależności objętości od ciśnienia. Jego współczynniki można powiązać ze
współczynnikiem ściśliwości (κ).
27. Stały hydrat A⋅nH2O może rozpaść się według reakcji A⋅nH2O(s) = A(s) + nH2O(g)
Obliczyć minimalną wilgotność względną powietrza (w/%), dla której hydrat ten jest trwały "w otwartym
naczyniu" w temperaturze T0 i pod ciśnieniem atmosferycznym po. Przyjąć znajomość podstawowych danych
termodynamicznych dla wszystkich składników w temperaturze 298 K (proszę je wypisać i oznaczyć
jednoznacznymi symbolami). Można założyć, że standardowa różnica pojemności cieplnych dla reakcji równa
się zeru.
Rozwiązanie:
Hydrat będzie trwały, jeśli
pH 2O > pr = p0 K 1/ n
(27.1)
Ciśnienie cząstkowe pary wodnej (z definicji wilgotności względnej) równa się pH 2O = wpHo 2O
gdzie p Ho 2O jest prężnością pary nasyconej nad czystą wodą.
Wyrażając równanie (27.1) w funkcji wilgotności względnej, otrzymujemy
wmin
∆H o ∆S o
= p0 exp −
+
R
RT
1/ n
/ pHo 2O
28. W ciekłej mieszaninie A + B występuje ograniczona mieszalność (tzn. że w pewnym zakresie stężeń i
temperatur obserwuje się dwie fazy ciekłe w równowadze). Zakładając, że układ da się opisać modelem roztworu
prostego w postaci GE = AxAxB ⇒ RTlnγA = AxB2; RTlnγB = AxA2; A = a + b/T; a,b ≠ T, przedstawić algorytm
umożliwiający obliczenie składu współistniejących faz ciekłych w dowolnej temperaturze.
Rozwiązanie:
W stanie równowagi pomiędzy dwiema cieczami (α, β), równe są aktywności obu składników w każdej ze
współistniejących faz
Biotechnologia - chemia fizyczna/ Termodynamika techniczna i chemiczna – zadania egzaminacyjne
10
xαA γ αA = x Aβ γ Aβ
xαB γ Bα = x Bβ γ Bβ
Wyrażając współczynniki aktywności poprzez zależności wynikające z modelu roztworu prostego, otrzymujemy
ln xαA + ln γ αA = ln x Aβ + ln γ Aβ
α
ln xB + ln γ Bα = ln xBβ + ln γ Bβ
A α2
A β2
α
β
ln x A / x A + RT xB = RT xB
ln xα / x β + A xα 2 = A x β 2
B
B
A
A
RT
RT
A α2
ln xαA / x Aβ +
xB − xBβ 2 = 0
RT
ln xα / x β + A xα 2 − x β 2 = 0
B
B
A
A
RT
α
β
α2
β2
RT ln x A / x A + (a + b / T ) xB − xB = 0
RT ln xBα / xBβ + (a + b / T ) xαA 2 − x Aβ 2 = 0
(
)
(
)
(
)
(
)
(
)
(
)
(
(
)
)
(
(
)
)
Skład dwóch faz ciekłych w stanie równowagi wyznaczy się z rozwiązania powyższego układu równań względem
xAα, xBβ.
29. Wyprowadzić związek pomiędzy współczynnikiem rozszerzalności, ściśliwości i prężności.
Rozwiązanie:
Przedstawmy różniczkę zupełną V(T,p).
dV = (∂V/∂T)pdT + (∂V/∂p)Tdp = αVdT - κVdp
stąd wyznaczamy dp
dp = (α/κ)dT - (1/κV)dV
otrzymując różniczkę zupełną p(T,V). Wyraz wymnożony przez dT jest pochodną (∂p/∂T)V, czyli współczynnikiem
prężności. A zatem mamy
β = α/κ
30. Stwierdzono eksperymentalnie, że stała równowagi pewnej reakcji praktycznie nie zależy od temperatury, tj.
K = A = const. Obliczyć standardową entalpię i standardową entropię tej reakcji.
Rozwiązanie:
Ponieważ
∆G o
= const
RT
∆G o = − RT ln K
ln K = −
∂∆G o
= − R ln K = − R ln A
∆S o = −
∂T p
∆H o = ∆G o + T∆S o = − RT ln A + RT ln A = 0
Biotechnologia - chemia fizyczna/ Termodynamika techniczna i chemiczna – zadania egzaminacyjne
11
31. Przedstawić zależność izobarycznego współczynnika rozszerzalności temperaturowej od parametrów stanu
(p,V,T,n) dla czystego gazu opisywanego równaniem stanu van der Waalsa.
Rozwiązanie:
−1
α=
1 ∂V
1 ∂T
=
V ∂T p V ∂V p
a
p + 2 (V − b ) = RT
V
1
a ab
T = pV − pb + − 2
R
V V
1
a 2ab
∂T
= p− 2 + 3
V
V
∂V p R
Możliwe są dalsze przekształcenia, jśli chcemy α wyrazić tylko poprzez V i T. Wtedy będzie
1 RT
2a 2ab
∂T
− 2+ 3
=
V
∂V p R V − b V
I ostatecznie
α=
R RT
2a 2ab
− 2+ 3
V V − b V
V
−1
32. Nadmiarowa entalpia swobodna w układzie dwuskładnikowym (1) + (2) opisywana jest wyrażeniem:
GE = (a1 + a2/T)x1x2
[J/mol] a1,a2 ≠ f(T,p,x1)
Napisać (lub opisać) równania izobary równowagi ciecz-para: T = T(p=p*=const,x1) i T = T(p=p*=const,y1),
gdzie y1 jest ułamkiem molowym w fazie gazowej a stałe ciśnienie p* jest niewielkie. Składnik (2) jest nielotny a
prężność pary nasyconej nad czystym składnikiem (1) może być opisana równaniem Antoine'a, tj. lnp = A - B/(TC).
Wskazówka: Dla roztworu prostego, tj. dla GE = Ax1x2, współczynniki aktywności wynoszą: RTlnγ1 = Ax22 ;
RTlnγ2 = Ax12
Rozwiązanie:
Ze względu na nielotność jednego składnika (2), w fazie gazowej będzie występować tylko składnik (1), a
równanie wiążące parametry w stanie równowagi będzie miało postać
p = p10 (T )x1γ 1 (T , x1 ) = const
co ze względu na charakter równań p10 (T ), γ 1 (T , x1 ) wygodniej jest przedstawić w postaci logarytmicznej
ln( p / x1 ) = ln p10 (T ) + ln γ 1 (T , x1 )
ln( p / x1 ) = A −
(a + a / T ) (1 − x )2
B
+ 1 2
1
T −C
RT
Izobarę T = T(p=p*=const, x1) uzyskuje się z powyższego równania, poprzez rozwiązanie go względem T. Jest to
równanie 3-go stopnia. izobara T = T(p=p*=const, y1) to prosta o równaniu x1 (y1) = 1.
33. n moli gazu dającego opisać się równaniem stanu van der Waalsa, sprężonych początkowo do ciśnienia p1
większego od ciśnienia atmosferycznego po, rozpręża się izotermicznie przez otwarcie zbiornika do atmosfery.
Przedstawić algorytm (w punktach) umożliwiający obliczenie efektu cieplnego przemiany.
Wykonanie samych obliczeń będzie dodatkowo premiowane.
Rozwiązanie:
Biotechnologia - chemia fizyczna/ Termodynamika techniczna i chemiczna – zadania egzaminacyjne
12
Efekt cieplny oblicza się z bilansu energii wynikającej z I zasady
Q = ∆U-w
Algorytm:
1. Obliczyć ∆U poprzez scałkowanie ∂U (z wykorzystaniem równania stanu).
∂V T
2. Obliczyć pracę w = -po(V1-Vo).
Konieczna będzie znajomość objętości, które trzeba wyliczyć z równania stanu van der Waalsa (równanie
trzeciego stopnia).
34. O ile zmieni się temperatura rozpuszczalności stałego składnika (1) w ciekłym roztworze (1) + (2) w
stosunku do rozpuszczalności doskonałej? Niedoskonałości roztworu ciekłego można wyrazić modelem roztworu
prostego w następującej formie: (GE = Ax1x2, gdzie A = a + bT; współczynniki aktywności wynoszą: RTlnγ1 =
Ax22; RTlnγ2 = Ax12). Dysponujemy wszystkimi potrzebnymi parametrami opisującymi właściwości czystych
składników (jakie to parametry będą potrzebne ?)
Rozwiązanie:
Równanie rozpuszczalność ma postać
1 1
R ln x1 = − ∆H t1 − − R ln γ 1
T Tt1
Wyrażenie współczynnika aktywności poprzez równanie wynikające z modelu roztworu prostego prowadzi do
1 1 a
R ln x1 = −∆H t1 − − + b x22
T
T
T
t1
Stąd temperatura rozpuszczalności
T=
∆H t1 + ax22
∆H t1 / Tt1 − R ln x1 − bx22
a temperatura rozpuszczalności dla roztworu doskonałego
T id =
∆H t 1
∆H t1 / Tt1 − R ln x1
35. Dla n moli pewnego gazu spełnione są następujące zależności
cp = n(a1+ a2T + a3T2) ai ≠ f(T,p); p(V - nb) = nRT b ≠ f(T,p)
Wyprowadzić wyrażenie na zmianę entropii 1 mola tego gazu dla przemiany (p1,T1 ) → (p2,T2).
Uwaga: Jedną z potrzebnych pochodnych można znaleźć z relacji Maxwella zastosowanej do różniczki zupełnej
entalpii swobodnej, tj. dG = -SdT + Vdp
Rozwiązanie:
Potrzebne pochodne to
c p ∂S
∂S
∂V
= ; = −
∂
p
∂T p T
∂T p
T
Po podstawieniu równań na cp i równania stanu
nR
∂S
a
∂S
= n 1 + a2 + a3T ; =
p
∂T p
T
∂p T
Po scałkowaniu otrzymujemy ostateczne wyrażenie
T
p
∆S = n a1 ln 2 + a2 (T2 − T1 ) + 12 a3 T22 − T12 + R ln 2
T1
p1
(
)
Biotechnologia - chemia fizyczna/ Termodynamika techniczna i chemiczna – zadania egzaminacyjne
13
36. Kawałek metalu o gęstości wynoszącej do pod początkowym ciśnieniem po, ogrzewa się w zamkniętym
naczyniu od temperatury T0 do T1. Obliczyć końcowe ciśnienie. Dostępny jest pełny opis właściwości pVT
substancji (poprzez znajomość współczynników: rozszerzalności izobarycznej i ściśliwości izotermicznej - α, κ).
Rozwiązanie:
Kluczem jest pochodna
∂p
= α /κ
∂T V
Stąd po scałkowaniu
p1 = p0 + α (T1 − T0 ) / κ
37. Pewna ilość gazu o objętości początkowej V0, dającego opisać się równaniem wirialnym obciętym do
drugiego współczynnika tj. pV = n(RT + Bp)
rozpręża się bardzo powoli od ciśnienia p1, przy zmieniającym się ciśnieniu zewnętrznym (w praktyce zatem
odwracalnie) i izotermicznie, poprzez otwarcie zbiornika do atmosfery (p=po). Obliczyć pracę wykonaną przez
ekspandujący gaz.
Rozwiązanie:
V
p
2
2
∂V
w = − ∫ pdV = − ∫ p
∂p
V1
p1
p
2
nRT
dp = ∫ p 2
p
T
p1
p
2
dp
p
dp =nRT ∫
=nRT ln 2
p
p1
p1
38. Dla niewielkich różnic temperatur i ciśnień można założyć, że objętość cieczy jest liniową funkcją
temperatury i ciśnienia, co może być wyrażone wzorem: V = nVo[1 + aT(T-To)][1 + ap(p-po)] , gdzie Vo jest
objętością molową dla T = To i p = po.
Obliczyć zmianę ciśnienia podczas izochorycznego ogrzewania próbki cieczy od temperatury T0 i ciśnienia p0, do
temperatury T2.
Rozwiązanie:
[
]
Stałość objętości oznacza, że wyrażenie [1 + aT (T1 − T0 )]1 + a p ( p1 − p0 ) równa się jedności.
Stąd
p1 − p0 =
aT (T1 − T0 )
a p [1 + aT (T1 − T0 )]
39. n moli gazu o molowej pojemności cieplnej cp = a + bT + cT2 + d/T oziębia się izobarycznie od temperatury
T2 do T1. Obliczyć efekt cieplny przemiany. Jaki będzie jego znak?
Rozwiązanie:
Q = ∆H (dla p = const)
∂H
2
= c p = a + bT + cT + d / T
∂
T
p
Po scałkowaniu
(
)
(
)
Q = ∆H = a (T2 − T1 ) + 12 b T22 − T12 + 13 c T23 − T13 + d ln
T2
T1
Ponieważ cp > 0, spadek temperatury spowoduje zmniejszenie entalpii i Q < 0.
Biotechnologia - chemia fizyczna/ Termodynamika techniczna i chemiczna – zadania egzaminacyjne
14
40. Stwierdzono, że dla pewnej substancji pojemność cieplna pod stałym ciśnieniem jest praktycznie niezależna
od temperatury (dla cieczy) i wykazuje liniową zależność od temperatury (dla gazu i pary). Jaki charakter
matematyczny ma zależność prężności pary nasyconej od temperatury pod niskimi i umiarkowanymi ciśnieniami
dla tej substancji?
Rozwiązanie:
Bezpośrednią konsekwencją założenia będzie zależność entalpii parowania od temperatury, zgodnie z relacją
∂∆H par
∂T
= c pg − c cp = a '+b' T
p
Po scałkowaniu otrzymamy zależność entalpii parowania od temperatury w postaci wielomianu drugiego
stopnia. Przyjmując doskonałość fazy gazowej i pomijalność objętości fazy ciekłej, równanie Clapeyrona będzie
miało postać
∂ p
a + bT + cT 2 p(a + bT + cT 2 )
=
=
TRT / p
RT 2
∂ T sat
∂ p
a b
= p ( 2 + + c)
R
∂
T
T
T
sat
I po scałkowaniu
p
1 1
T
R ln 2 = −a − + b ln 2 + c(T2 − T1 )
p
T
T
1
2
1
T1
41. Dla reakcji zachodzącej izobarycznie w fazie gazowej i pod umiarkowanymi ciśnieniem, typu
A + B = AB
standardowa entalpia swobodna w temperaturze T wynosi ∆G°. Przedstawić zależność ułamka molowego AB w
stanie równowagi od ciśnienia, jeśli reakcja została zapoczątkowana poprzez zmieszanie substratów w stosunku
molowym 1:1. Co się zmieni w układzie i jakie parametry będą potrzebne, żeby opisać to ilościowo, jeśli
zwiększy się temperatura?
Rozwiązanie:
Równomolowa ilość substratów sprawia, że ułamki molowe A i B będą sobie równe. Stąd w stanie równowagi
x AB p0
2
∆G o
= K = exp −
RT
1 − x AB
p
2
4 x AB p0
=K
(1 − x AB )2 p
Szukaną zależność znajduje się poprzez rozwiązanie powyższego równania względem xAB (równanie
kwadratowe).
Zmiana temperatury wpływa na K, stąd uwzględnienie tego efektu wymaga znajomości ∆Ho i ∆So (potrzebne
parametry: standardowe entalpie tworzenia, standardowe entropie i ewentualnie jeszcze zależności
temperaturowe standardowych pojemności cieplnych - dla każdego reagenta).
42. W naczyniu w kształcie walca o promieniu r, zamkniętym ruchomym tłokiem, znajduje się ciecz o
współczynnikach rozszerzalności i ściśliwości = α, κ. Na tłoku usytuowanym poziomo, położono ciężar o masie
m przekraczającym kilka ton. W chwili początkowej słup cieczy wynosił h0. O ile kelwinów należy podgrzać
zbiornik, aby podnieść ciężar na wysokość h > h0?
Rozwiązanie:
Paradoksalna prostota tego zadania może być uświadomiona po właściwym zinterpretowaniu faktu zamknięcia
zbiornika tłokiem w dużym ciężarem. Co to oznacza? Jedynie to, że ciecz jest pod bardzo wysokim ciśnieniem,
Biotechnologia - chemia fizyczna/ Termodynamika techniczna i chemiczna – zadania egzaminacyjne
15
które nie będzie się zmieniać podczas ogrzewania. W związku z czym, końcowa objętość wynika jedynie ze
scałkowania definicji współczynnika rozszerzalności
ln
h
V
= ln = α (T − T0 )
h0
V0
T = T0 +
1
α
ln
h
h0
Jeśli α będzie niezależne o ciśnienia, wynik dla przemiany pod ciśnieniem atmosferycznym będzie taki sam (!).
Jest to dobra ilustracja przybliżonego charakteru przyjmowanych założeń.
43. Prężność pary nasyconej nad pewną substancją wyraża się wzorem: lnp = A + B/T + C/T2
Obliczyć ilość energii, którą trzeba dostarczyć w celu odparowania m kg substancji o masie molowej M g/mol i
pod ciśnieniem p0.
Rozwiązanie:
Jest to pytanie o zmianę energii parowania. Dla wartości molowych prawdziwy będzie związek
∆Upar = ∆Hpar – RT
Entalpię parowania można obliczyć z krzywej parowania, wykorzystując równanie Clapeyrona (przy założeniu
doskonałości fazy gazowej i przy pominięciu objętości fazy ciekłej)
B 2C
∂ ln p
2
∆H par = RT 2
= RT − 2 − 3 = − R(B + 2C / T )
∂
T
T
T
Stąd ostateczny wynik będzie
∆U = n∆U par = −
m
R(B + T + 2C / T )
M
44. Tlenek MeO(s) może rozpaść się według reakcji
MeO(s) = Me(s) + 1/2O2(g)
Stabilność tlenku zależy od dwóch parametrów (jakich ?). Naszkicować (jakościowo) diagram stabilności,
definiując pola odpowiadające wartościom parametrów, w których MeO jest stabilny i w których jest nietrwały.
Wskazówki: 1) Można założyć, że ∆cp° = 0; 2) Przyjmujemy dostępność podstawowych danych
termodynamicznych; 3) Jako zmienne układu współrzędnych wygodnie jest przyjąć nie dwa podstawowe
parametry, a ich proste funkcje; 4) Standardowa entalpia tworzenia MeO(s) ma wartość ujemną.
Rozwiązanie:
Tlenek jest trwały, jeśli
pO2 > pr = p0 K (T )
2
Parametrami, które decydują o trwałości są: ciśnienie
cząstkowe tlenu i temperatura.
Przedstawiając nierówność w postaci logarytmicznej
mamy
∆H 0 ∆S 0
ln pO2 / p0 > 2 −
+
R
RT
(
tlenek trwały
lnpO2
)
Diagram stabilności we współrzędnych ln pO2 = f(1/T)
będzie linią prostą – patrz →
tlenek nietrwały
1/T
45. Dwie substancje ciekłe A i B mieszają się w sposób nieograniczony i podczas mieszania w warunkach (p,T =
const) nie obserwuje się zmiany objętości (to znaczy, że objętość mieszaniny równa się sumie objętości obu
składników). Dla mieszaniny o określonym składzie, wyrazić gęstość i izobaryczny współczynnik rozszerzalności
jako funkcje gęstości i współczynników rozszerzalności obu składników.
Biotechnologia - chemia fizyczna/ Termodynamika techniczna i chemiczna – zadania egzaminacyjne
16
Rozwiązanie:
Związki pomiędzy gęstościami podaje poniższe wyprowadzenie; wA, wB oznacza ułamki wagowe, parametr bez
indeksu (A, B) odnosi się do mieszaniny.
V = x AVA + xBVB
M
M
M
= x A A + xB B
d
dA
dB
M A x A + M B xB
M
M
= x A A + xB B
d
dA
dB
1
1
1
= wA
+ wB
d
dA
dB
Następne jest wyprowadzenie zależności pomiędzy współczynnikami ściśliwości; φA, φB oznacza ułamki
objętościowe.
∂V
∂V
∂V
= x A A + xB A
∂
∂
P
P
T
T
∂P T
− κV = − x AV Aκ A − xBV Aκ A
x AV Aκ A xBVAκ A
+
V
V
κ = ϕ Aκ A + ϕ Bκ B
κ=